8 juillet 2025
 6 min
6 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


20 janvier 2022
Le règlement médicament 2022 s'applique le 28 janvier. Les prescriptions s'allongent avec les principes actifs et « toutes les mises en garde pour le bon usage ». Prêts ?

J-8. Le 28 janvier 2022 exactement, le nouveau règlement européen « médicament vétérinaire » 2019/6 entre en application en France comme partout dans l'Union européenne (UE27). Depuis 2019, une dizaine de Fils ont déjà décortiqué cette nouvelle réglementation. L'Afvac a aussi consacré un module sur ce thème à son dernier congrès de Bordeaux avec la participation de l'Agence du médicament vétérinaire. Elle vient aussi d'organiser deux webinaires les 14 et 19 janvier derniers préparés par l'auteur de ce Fil d'aujourd'hui. Alors fin prêts pour la bascule ?
À très court terme, dans une semaine, quelques-unes de vos pratiques devront être modifiées, surtout sur la rédaction des ordonnances avec de nouvelles mentions obligatoires. La nouvelle cascade est plus flexible mais impose aussi, pour la rurale, de nouveaux temps d'attente. Seuls ces deux changements directement applicables au 28 janvier 2022 sont analysés dans ce Fil sous forme de questions-réponses.
Notre réglementation française ne sera pas prête pour le 28 janvier 2022. Mais, en cas d'écart, le droit européen prime toujours sur le droit national. Comme tous les règlements européens, celui-ci s'applique directement en France et dans toute l'UE27 à partir du 28 janvier 2022 sans nécessiter de transposition dans le droit national comme c'était le cas jusqu'à présent pour l'ancienne directive « médicament vétérinaire » 2001/82. À partir 28 janvier 2022, les mêmes règles s'appliquent donc à tous les États membres, que leur droit national ait été modifié ou non.
Il est évidemment néanmoins nécessaire d'adapter la réglementation française sur la pharmacie vétérinaire, principalement le code de la santé publique, pour la rendre compatible avec ce nouveau règlement et éviter les confusions.
Il convient d'abord de supprimer les doublons voire les écarts ou les divergences entre notre ancien droit national et ce nouveau droit européen. À titre d'exemple, le dispositif de la cascade est fortement modifié avec les articles 112 à 115 de ce règlement européen. Dans le droit français, la cascade figure à l'article L. 5143-4 du code de la santé publique. À partir de 28 janvier 2022, c'est la nouvelle cascade qui s'applique et non l'ancienne.
En outre, le règlement européen permet aux États membres de prendre des initiatives dans leur droit national, par exemple pour autoriser les ventes en ligne, la publicité pour des vaccins auprès des éleveurs ou le déconditionnement à l'unité des comprimés… Pour faire jouer ces options, il convient de prendre les textes correspondant dans le code de la santé publique.
Pour modifier la partie législative du code de la santé publique, le gouvernement a jusqu'au 4 avril 2022 (une semaine avant les élections présidentielles) pour légiférer par ordonnance législative sur ce point. Un texte est en phase finale de concertation en vue de sa publication avant le 4 avril.
Les points les plus importants sont dans la partie réglementaire du code de la santé publique qui ne peut pas être modifiée avant la partie législative. De nombreux décrets et arrêtés d'application sont donc attendus pour adapter notre droit et lever les options qui sont ouvertes par ce règlement européen.
Seuls les décrets les plus urgents seront publiés dans le courant de l'année 2022. Les autres seront publiés en 2023 ou plus tardivement. Le travail sera long, sans doute étalé sur plusieurs années, tout le prochain quinquennat…
À partir du 28 janvier 2022, la nouvelle ordonnance comprendra entre deux et quatre mentions supplémentaires (article 105 (5) du règlement 2019/6).
Pour toutes les ordonnances, il convient d'ajouter au moins deux mentions :
Pour les substances actives, cela ne devrait pas être trop difficile pour les médicaments contenant un, deux voire jusqu'à trois substances actives assez simples. Cela devient plus compliqué dès lors qu'il s'agit de médicaments complexes.
Pour les mises en garde, il ne s'agit pas, semble-t-il, de faire un copier-coller de toutes les précautions qui sont détaillées aux rubriques 4.4 et 4.5 des RCP officiels (résumés des caractéristiques du produit). Car cela conduirait à reproduire la notice dans l'ordonnance.
Dans le même esprit, les autorités françaises ne semblent pas favorables à ce que les vétérinaires se satisfassent de cette nouvelle obligation avec une mention fixe du type « mises en garde : lire la notice ». Cette solution aurait pourtant le mérite de la simplicité !
En fait, il s'agit de mentionner des mises en garde spécifiques à l'animal traité ou à son environnement du type :
En outre, si le médicament est prescrit dans le cadre de la cascade, dans une indication qui n'est pas celle prévue dans le RCP, l'ordonnance le précise explicitement avec une mention comme « prescription hors AMM ».
Enfin, pour les antimicrobiens, ce qui inclut les antibiotiques, les antifongiques, les anticoccidiens…, l'ordonnance précise explicitement si ces médicaments sont prescrits en prévention — le traitement d'un animal sain exposé à un risque élevé d'infection — ou en en métaphylaxie, le traitement collectif d'un groupe d'animaux comprenant des individus malades avec un risque élevé de la diffusion de l'infection aux animaux sains de ce groupe.
Dans de tels cas, l'ordonnance précise explicitement que l'antimicrobien est prescrit en prévention ou en métaphylaxie.
À compter du 28 janvier 2022, l'antibioprévention ou l'usage préventif d'un autre antimicrobien ne sont pas totalement interdits. Mais cette prévention est fortement restreinte « à des cas exceptionnels, pour un seul animal individuel ou un nombre restreint d'animaux, lorsque le risque d'infection ou de maladie infectieuse est très élevé et que les conséquences ont toutes les chances d'être graves ». Cela ne permet donc pas de recourir à un antimicrobien de manière systématique (art. 107).
Pour les antibiotiques, l'administration est nécessairement individuelle, une injection, un comprimé, un intramammaire lors du tarissement d'une vache laitière pour éviter de nouvelles infections si ce risque est élevé. Pour les anticoccidiens, l'administration collective préventive à un nombre restreint d'animaux est possible.
L'ordonnance rédigée par un vétérinaire français est valable dans toute l'UE. Cela permet à un propriétaire qui voyage dans l'UE avec son chien cardiaque de pouvoir obtenir le médicament de son chien dans toute l'UE sans recourir aux services d'un vétérinaire local pour obtenir une nouvelle ordonnance.
En revanche, cela ne permet pas à un éleveur d'aller acheter en Espagne des médicaments moins chers qu'en France pour les utiliser ensuite en France. Les médicaments présents sur le territoire français, chez un grossiste, chez un vétérinaire ou chez un éleveur devront toujours disposer d'une autorisation valable en France, leur AMM dans le cas général, avec un étiquetage en français.
Enfin, avec ces nouvelles ordonnances, les quantités délivrées correspondent aux quantités prescrites. Une ordonnance pour laquelle toutes les quantités prescrites ont été délivrées — ce qui est très souvent le cas — n'est donc plus valable pour une nouvelle délivrance.
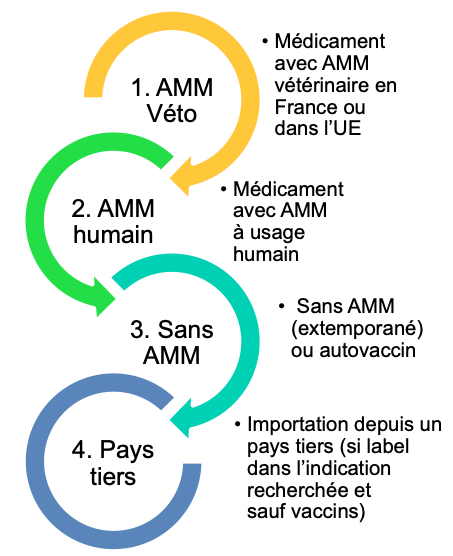
Indéniablement, la nouvelle cascade dite du « hors AMM » est plus simple avec, dès le 1er niveau, tous les médicaments qui disposent d'une AMM valable en France ou dans un autre pays de l'UE [art. 112 à 114]. Pour importer un médicament dans le cadre de cadre de la cascade, il conviendra toutefois de solliciter une autorisation d'importation auprès de l'Agence du médicament vétérinaire (voir ce lien).
Le déclenchement de la cascade n'est toutefois pas modifié de manière significative. Le vétérinaire peut, sans y être contraint, « traiter des animaux » dans le cadre de la cascade « lorsqu'il n'existe pas de médicament vétérinaire autorisé dans l'État membre [où il exerce] pour une indication concernant une espèce animale ». Il est aussi désormais précisé qu'une rupture ou l'absence de disponibilité d'un médicament autorisé mais pas commercialisé ouvre droit à la cascade [art. 112 à 114].
Dans le cadre de la cascade, le vétérinaire peut « traiter les animaux » avec, au premier niveau, un accès à tous les médicaments avec une AMM vétérinaire dans l'UE (France incluse) « dans ou hors RCP ». En d'autres termes, le vétérinaire a d'emblée accès à tous les médicaments vétérinaires autorisés en Europe et non pas seulement à ceux disponibles en France. La cascade devient donc bien un lac. Trois niveaux de l'ancienne cascade sont rassemblés en un seul !
Pour faciliter ce recours, la base de données de tous les médicaments autorisés dans l'UE sera accessible avec les RCP de chacun d'entre eux. Dans le cadre de la cascade, il ne devrait pas être exigé que la notice du médicament importé soit traduite. Aujourd'hui, l'importation thérapeutique depuis un État membre de l'UE est au troisième niveau de la cascade. À compter du 28 janvier 2022, ces importations à but thérapeutiques seront envisageables dès le premier niveau mais nécessiteront toujours une autorisation de l'Anses. Le formulaire pour déposer une demande est disponible sur ce ce lien. Il est ensuite à transmette par mail à l'adresse enreg@anses.fr.
Cette cascade s'applique aux animaux de compagnie et aux équidés exclus de la consommation humaine [art. 112].
Dans les productions animales terrestres [art. 113] ou aquatiques [art. 114], le règlement rappelle l'obligation que la substance active dispose d'une limite maximale de résidus, mais pas nécessairement dans la denrée de l'espèce animale visée.
Dans les productions animales terrestres (mammifères et volailles), la cascade est quasi-identique à celle pour les animaux de compagne à une nuance près. Il convient d'abord de privilégier un médicament avec une AMM vétérinaire dans l'UE déjà approuvé dans une production animale terrestre, la même espèce que celle visée ou une autre. L'importation d'un médicament avec une AMM vétérinaire dans un autre État membre est possible dès le premier niveau, y compris dans les cas de rupture du médicament en France.
Sur les temps d'attente, le changement est important. Si le médicament est utilisé « hors AMM » mais dans la même espèce, le temps d'attente prévu n'est pas allongé [art. 115]. Il s'agit seulement d'un changement d'indication. Sinon, les temps d'attente minimaux à appliquer sont les suivants :
8 juillet 2025
 6 min
6 min

7 juillet 2025
 4 min
4 min

4 juillet 2025
 3 min
3 min
3 juillet 2025
 5 min
5 min

2 juillet 2025
 4 min
4 min

1er juillet 2025
 4 min
4 min
