9 janvier 2026
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


30 avril 2019
Règlement médicament (7). La nouvelle cascade devient un lac avec une importation dès le premier niveau
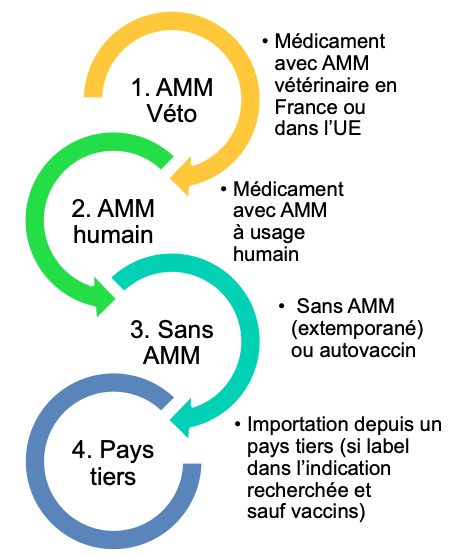
Et si, le 28 janvier 2022, la fameuse cascade dite du « hors AMM » devenait un lac avec l'application du nouveau règlement médicament vétérinaire 2019/6 publié le 7 janvier dernier (voir LeFil du 8 janvier 2019).
Apparemment, la ou plutôt les nouvelles cascades — car il y en a trois différentes selon les espèces cibles — comprennent toujours quatre ou cinq niveaux. Mais, le premier niveau de cette cascade, est si large qu'il peut s'apparenter à un lac. C'était l'un des objectifs initiaux de cette réforme que de faciliter le recours à la cascade. Il est apparemment atteint, même si la prise en compte des espèces aquatiques, des abeilles et du miel en a fortement allongé la rédaction.
Ce septième Fil de notre série sur ce nouveau règlement « médicament vétérinaire » décortique la nouvelle cascade après ceux consacrés à la prescription (voir les Fils du 21 février etl du 25 février), à la distribution en gros (LeFil du 12 mars), aux importations parallèles (LeFil du 26 mars), aux ayants droit (LeFil du 9 avril) et aux ventes en ligne (LeFil du 23 avril 2019).
« Les médicaments vétérinaires sont utilisés conformément aux termes de l'autorisation de mise sur le marché (AMM) », selon l'article 106 (§1) du nouveau règlement. Pour la première fois dans un texte européen, cette phrase contraint les utilisateurs à ne pas dévier du résumé officiel des caractéristiques du produit (RCP) qui fait partie des « termes de l'AMM ». Le dispositif de la cascade s'inscrit donc comme une dérogation à cet usage conforme au RCP.
Paradoxalement, le nouvel étiquetage des médicaments sur ordonnance ne comportera plus les indications pour inciter les utilisateurs finaux à se référer à l'ordonnance du vétérinaire plutôt qu'à l'étiquetage de l'emballage extérieur (art. 11).
Sans changement, le vétérinaire peut, sans y être contraint, « traiter des animaux » dans le cadre de la cascade « lorsqu'il n'existe pas de médicament vétérinaire autorisé dans l'État membre [où il exerce] pour une indication concernant une espèce animale ». Il est aussi désormais précisé qu'une rupture ou l'absence de disponibilité d'un médicament autorisé mais pas commercialisé, ouvre le droit à la cascade.
Selon ce texte, le vétérinaire ne devrait recourir à la cascade qu'« à titre exceptionnel, notamment afin d'éviter des souffrances inacceptables » [art. 112 à 114].
Même en se conformant à l'AMM ou au RCP, la responsabilité personnelle du vétérinaire prescripteur est toujours engagée sur son diagnostic et sur son ordonnance. Mais, dans des indications bien évaluées dans le cadre du dossier d'AMM, la probabilité pour qu'un vétérinaire commette une faute à l'origine d'un dommage — la mort de l'animal — est plus faible. Et la responsabilité du prescripteur n'est pas engagée sur l'usage qu'en fait au final le détenteur de l'animal qui utiliserait le médicament n'importe comment sans se conformer à son ordonnance.
Dans le cadre de la cascade, même l'usage « hors RCP » du médicament est « sous la responsabilité [civile] personnelle directe du vétérinaire ». Cela signifie que le vétérinaire soit administre lui-même le médicament utilisé « hors RCP », soit autorise un tiers, le détenteur de l'animal, à l'administrer mais sous la responsabilité du praticien [art. 112 à 114].
En d'autres termes, si la responsabilité du vétérinaire est toujours engagée sur la prescription d'un médicament prescrit « dans ou hors RCP », elle est, dans le cadre de la cascade, étendue à l'administration même si c'est le propriétaire de l'animal qui emploie mal le produit sans se conformer à la prescription.
Le règlement n'autorise d'ailleurs pas le vétérinaire à « prescrire des médicaments » dans le cadre de la cascade, mais à « traiter des animaux sous sa responsabilité personnelle directe ». Prescrire ou traiter, ce ne sont pas les mêmes actes qui sont visés. Les ordonnances des médicaments utilisés dans le cadre de la cascade devront d'ailleurs le mentionner explicitement cet usage « hors AMM ».
La nouvelle cascade applicable à compter du 28 janvier 2022
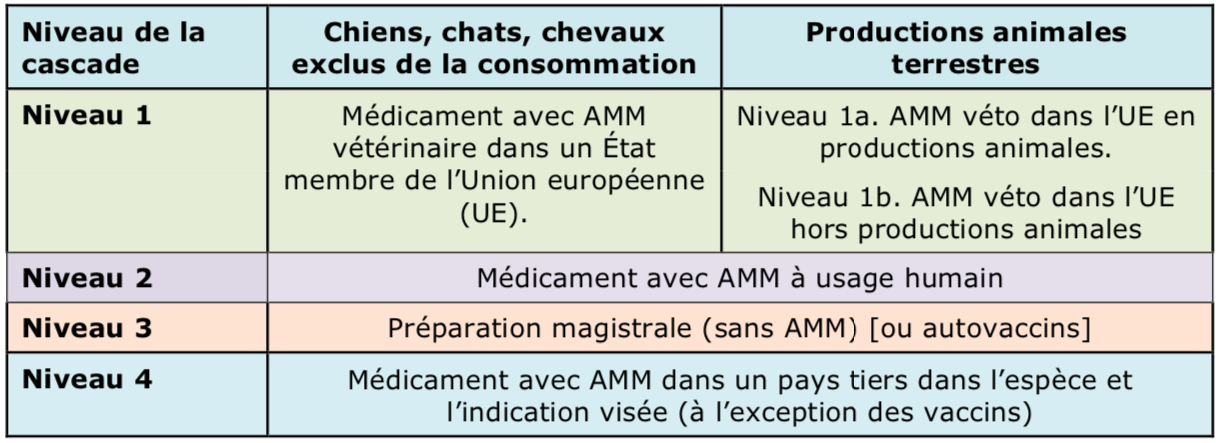
Dans le cadre de cascade dite du « hors AMM », le vétérinaire peut « traiter les animaux [exclus de la consommation humaine] » avec :
Cette cascade s'applique aux animaux de compagnie et aux équidés exclus de la consommation humaine [art. 112].
Le nouveau règlement distingue les productions animales terrestres [art. 113] des espèces animales aquatiques [art. 114]. Dans les deux cas, le règlement rappelle l'obligation que la substance active dispose d'une limite maximale de résidus, mais pas nécessairement dans la denrée de l'espèce animale visée.
Dans les productions animales terrestres, la cascade est quasi-identique à celle pour les animaux de compagnie à une nuance près. Il convient d'abord de privilégier un médicament avec une AMM vétérinaire dans l'UE (en Frane ou dans un autre État membre) déjà approuvé dans une production animale terrestre, la même espèce que celle visée ou une autre, dans la même indication ou une autre. Comme pour les animaux de compagnie, le recours est d'emblée possible vers l'ensemble des médicaments autorisés dans l'UE.
À défaut, le vétérinaire peut recourir à un médicament vétérinaire destiné aux animaux de compagnie et autorisé dans l'UE. Dans ce cas, il convient de vérifier que les substances actives ont des LMR, c'est-à-dire sont inscrites au tableau 1 des substances autorisées en productions animale en annexe du règlement LMR 470/2009.
À défaut, le vétérinaire peut aussi recourir à un médicament humain avec AMM, puis à une préparation extemporanée (« sans AMM ») ou un autovaccin. Comme pour les animaux de compagnie, l'importation depuis un pays tiers d'un médicament autorisé dans l'espèce et l'indication visées est envisageable, sauf pour des vaccins.
En cas de changement d'indication, mais sans changement d'espèce, le temps d'attente prévu n'est pas allongé [art. 115]. Sinon, les temps d'attente minimaux à appliquer sont les suivants :
Pour les productions aquacoles, la cascade est provisoirement assez proche de celles des productions terrestres [art. 114]. Mais, une liste de substances actives utilisables dans le cadre de la cascade devrait être établie avant le 28 janvier 2027 afin de tenir compte aussi des risques pour l'environnement. Les temps d'attentes de la cascade « aquacole » sont de 1,5 fois le temps d'attente le plus long d'un médicament indiqué pour une autre espèce aquacole exprimé °C.jour, ou fixés, selon les cas, entre 25 °C.jour à 500 °C.jour pour les médicaments non destinés aux espèces aquacoles.
Le dispositif des substances sans LMR mais dites essentielles aux équidés est conservé. Un règlement européen (n° 122/2013) a déjà publié une liste actualisée de 88 substances sans LMR, mais essentielles aux équidés non exclus de la consommation humaine (voir ce lien). L'usage de ces 88 médicaments sans LMR est autorisé chez ces équidés, même ceux destinés à la consommation humaine, à deux conditions :
Le nouveau règlement prévoit d'évaluer et éventuellement de revoir ce dispositif au plus tard pour le 29 janvier 2027. Avant cette date, la Commission présentera un rapport et d'éventuelles mesures sur les traitements des équidés et leurs exclusions de la chaîne alimentaire. Ce rapport devra aussi inclure la problématique des traitements des chevaux importés depuis des pays tiers [art. 158].
9 janvier 2026
 4 min
4 min

8 janvier 2026
 4 min
4 min

7 janvier 2026
 5 min
5 min

6 janvier 2026
 4 min
4 min

5 janvier 2026
 4 min
4 min

23 décembre 2025
 5 min
5 min
