18 décembre 2025
 5 min
5 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.



« Innover sur le génome, pour une meilleure santé et une vie plus gaie ». Le slogan de la société coréenne ToolGen, spécialisée dans les modifications ciblées du génome, pourrait presque se substituer au résumé de la publication scientifique que l'un de ses membres a cosigné dans Scientific Reports fin juillet : en modifiant un des gènes associé à un facteur de risque génétique de la dysplasie coxofémorale d'un Labrador retriever, puis en clonant le noyau de cette cellule, ces auteurs écrivent une nouvelle page de la reproduction animale, de plus en plus proche de ce qui était de la science-fiction il y a à peine une décennie. Une seconde société coréenne, MK biotech Inc., plus récente (ToolGen a été créée en 1999) et spécialisée dans les cellules souches, est aussi représentée parmi les cosignataires.
Certes, « la dysplasie coxofémorale est une maladie multifactorielle, provoquée par les interactions entre facteurs génétiques et environnementaux », reconnaissent les auteurs de cette publication, pour la plupart des biologistes et généticiens académiques de deux institutions coréennes. Ils ont déjà travaillé sur le sujet, en identifiant 25 mutations dans le génome du chien qui sont significativement associées à la survenue de dysplasie coxofémorale, et ont obtenu un brevet pour ces marqueurs en 2013. La technique des ciseaux moléculaires de CRISPR/Cas9 leur a fait rêver de pouvoir modifier l'ensemble de ces mutations chez un même individu, mais les modifications ciblées permises par la technique étaient encore trop imparfaites. Ce n'est qu'avec la mise au point d'une technique de “copier-coller génétique” de précision élevée (le ‘prime editing'), qu'ils ont décidé de passer à l'action. Cette technique a initialement été développée dans le cadre de la thérapie génique en humaine ; puis elle a été adaptée aux plantes, aux drosophiles et aux souris, mais jusque-là pas au chien.
Les auteurs ont donc choisi la mutation (SNP) qui présentait le niveau d'association le plus élevé avec la dysplasie, sur les 25 prédéterminées, et ont construit un vecteur ciblant cette mutation (une thymine remplacée par une cytosine) et comportant les éléments nécessaires pour le “copier-coller” (ARN amorce, modèle de réverse transcriptase, éléments enzymatiques nécessaires au fonctionnement de CRISPR, gène codant pour la luciférase, etc.). Puis ils ont réalisé une petite biopsie dans l'oreille d'un Labrador retriever de compagnie (homozygote pour la cytosine, C-C), ayant un diagnostic confirmé de dysplasie coxofémorale, pour en isoler des fibroblastes. Leur génome a été séquencé, confirmant la présence de la mutation que les auteurs souhaitaient corriger. Ils ont donc mis ces fibroblastes en culture, puis ont fait agir leur vecteur (transfection). Après 5 jours de culture, ils ont séquencé le génome de cellules une à une : dans l'une d'elles, ils obtenaient à la fois un C et un T au site voulu : la modification génétique a produit une cellule hétérozygote (C-T), qui se divise.
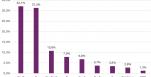
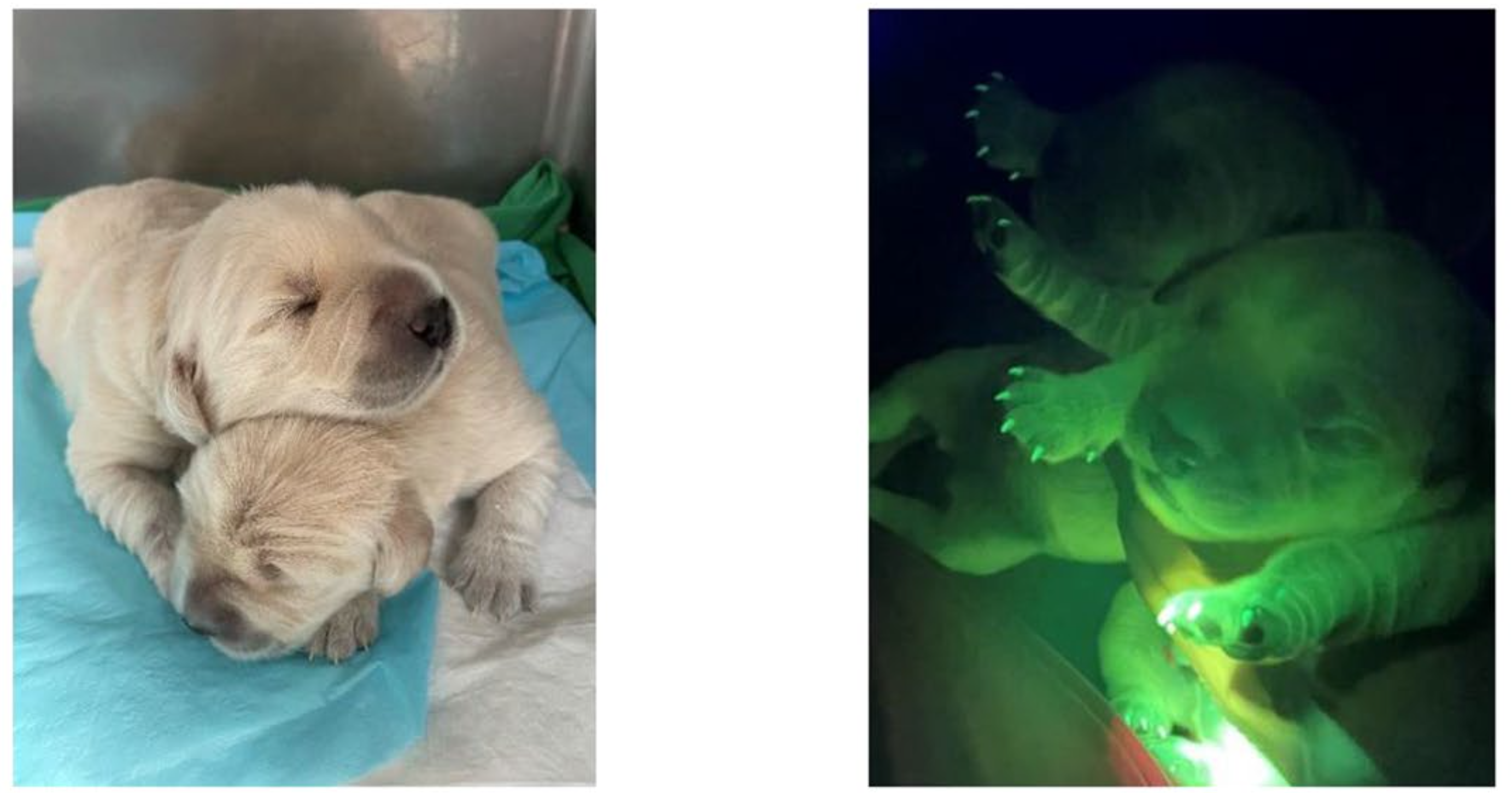
À partir de cette lignée, les auteurs étaient en terrain bien connu : le clonage par transfert nucléaire de cellule somatique (comme pour Dolly). Le noyau de ces fibroblastes a été incorporé à des oocytes de chiennes (n=42, trois donneuses) préalablement prélevés et énucléés. Puis les embryons obtenus (18 au total) ont été transférés dans l'utérus de chiennes receveuses (3 mères porteuses). Une seule gestation est arrivée à son terme, donnant naissance à deux chiots (voir l'image principale), nés par césarienne et pesant 656 et 585 g. Comme les auteurs avaient aussi inclus dans l'intervention l'insertion du gène de la luciférase (protéine devenant vert fluorescente à l'exposition aux UV), et qu'ils ont également séquencé le génome de chaque chiot, ils sont assurés que la modification génétique voulue a bien été conservée. Ils montrent aussi qu'il n'y a pas eu de modification génétique non voulue (en dehors du gène ciblé).
L'opération est réussie au plan génétique, mais rien ne permet d'affirmer qu'elle suffira à prévenir le développement d'une dysplasie coxofémorale sur ces animaux, qui seront examinés de près au long de leur croissance. Des « corrections génétiques supplémentaires sur les autres sites de mutations pourraient être nécessaires pour générer une race canine entièrement guérie de la dysplasie coxofémorale », reconnaissent les auteurs. Le présent résultat « est un point de départ », vers d'autres modifications génétiques en lien avec la dysplasie… Ou peut-être vers « une vie saine sans maladies, une vie riche avec des plantes et des animaux évolués », comme le vante le site de ToolGen ?
18 décembre 2025
 5 min
5 min

17 décembre 2025
 3 min
3 min

16 décembre 2025
 5 min
5 min

15 décembre 2025
 3 min
3 min
12 décembre 2025
 5 min
5 min
11 décembre 2025
 9 min
9 min