21 août 2025
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


14 décembre 2021
L'hyperparathyroïdie secondaire au Cushing s'expliquerait par une fuite urinaire de calcium
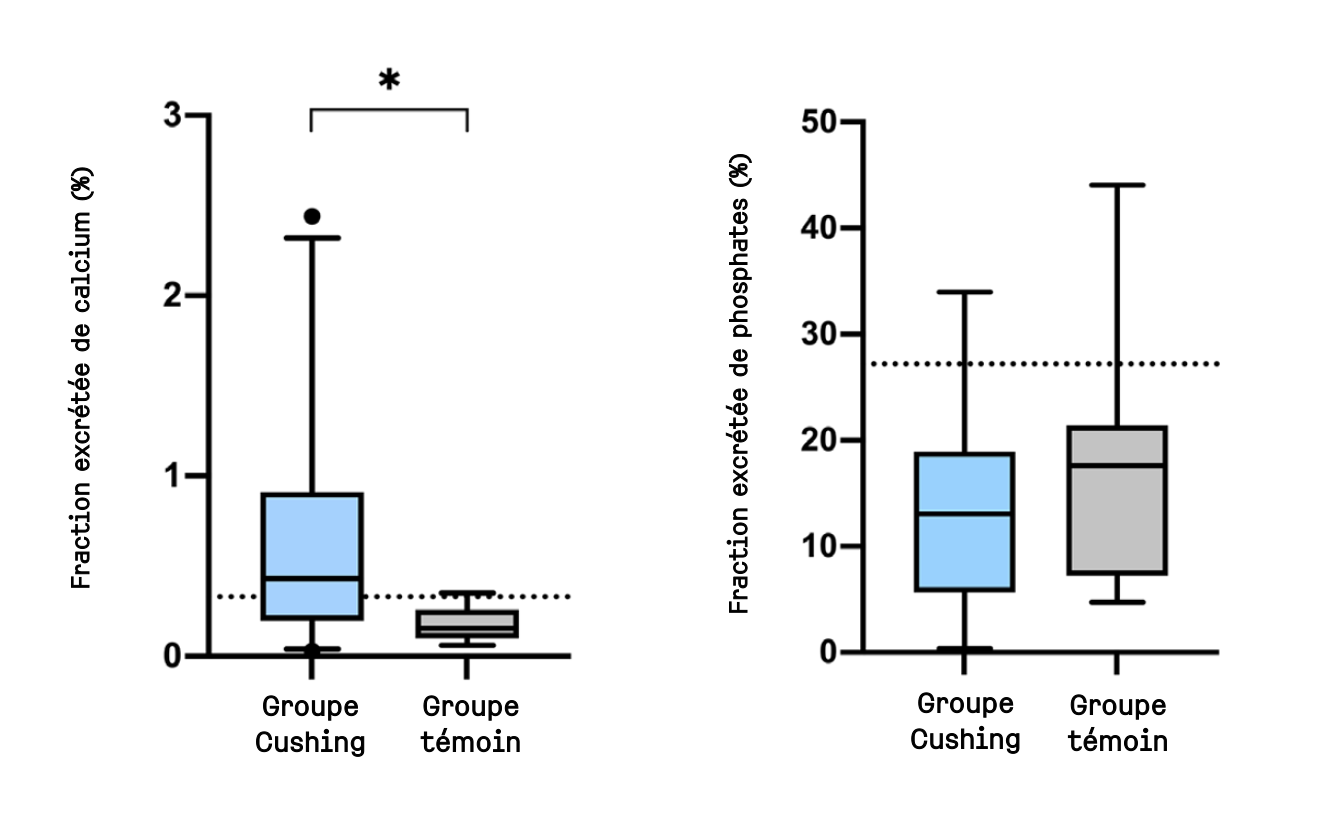
Le syndrome de Cushing spontané, d'origine hypophysaire ou surrénalienne, aurait des conséquences sur le métabolisme du calcium. Des lithiases urinaires contenant du calcium surviennent occasionnellement chez des chiens atteints, et une hyperparathyroïdie secondaire, caractérisée par une augmentation des taux de phosphate et de parathormone dans le sang, est assez fréquente. Cette hyperphosphatémie altère le pronostic du Cushing, mais suivant un mécanisme encore incompris.
Chez le chien, le Cushing d'origine hypophysaire est associé à une augmentation de l'excrétion urinaire de calcium et une diminution de celle de phosphate. Mais chez l'homme, l'excrétion urinaire des deux, phosphate comme calcium, est augmentée. Pour tenter d'expliquer le phénomène, une étude prospective a été menée chez des chiens nouvellement diagnostiqués avec un syndrome de Cushing. L'éventuelle influence de l'impact de la maladie sur le métabolisme de la vitamine D était notamment incluse dans les investigations. Car dans l'espèce humaine, il est l'un des facteurs à l'origine de l'ostéoporose observée chez les patients atteints d'hypercortisolisme.
L'étude s'est déroulée à l'hôpital vétérinaire universitaire de Bologne en Italie. 23 chiens chez lesquels un diagnostic de syndrome de Cushing venait d'être confirmé ont été inclus, ainsi que 12 chiens en bonne santé, suivis dans l'établissement pour leur bilan de santé annuel, afin de former un groupe témoin comparable en termes d'âge, de sexe et de poids. Les cas de Cushing iatrogène étaient écartés. Seuls des Cushing spontanés étaient retenus : 19 d'origine hypophysaire et 4 d'origine surrénalienne.
Des prélèvements de sang et d'urine (par cystocentèse) étaient effectués au même moment après 12h de jeûne, afin de mesurer :
Un bilan sanguin hématologique et biochimique complet était également pratiqué, ainsi qu'une analyse urinaire.
Les résultats de toutes ces analyses montrent des différences significatives chez les cas de Cushing par comparaison aux témoins sur les principaux paramètres suivants :
Les auteurs ont également séparé les chiens à Cushing en deux sous-groupes, selon la valeur de la parathormone circulante, anormalement élevée ou restant dans les normes. Et chez les premiers, le rapport calcitriol/calciférol est alors significativement augmenté (2,92 en médiane) par comparaison aux seconds (1,46) ou aux témoins (1,39).
Enfin, les auteurs ont recherché des corrélations entre ces paramètres. Et ils n'en établissent que deux, assez modérées, entre :
Ces résultats confirment la présence d'une hypercalciurie chez les chiens atteints d'un Cushing spontané. Cette fuite urinaire favorise probablement la formation de cristaux calciques urinaires tels que décrits occasionnellement.
La calcémie comme le calcium ionisé ne sont pas altérés ici. Ce qui suppose la mise en œuvre de mécanismes compensatoires, potentiellement par une mobilisation du calcium osseux (ce qui n'a pas été évalué ici), ou par une augmentation de l'absorption digestive, ce qui est moins probable étant donné que, chez l'homme au moins, une diminution de cette absorption s'observe lors d'hypercortisolisme.
L'hyperphosphatémie observée dans cette étude demeure inexpliquée. Elle pourrait toutefois être consécutive à une diminution de l'excrétion urinaire (non observée ici).
L'augmentation de la parathormone circulante conforte l'existence d'une hyperparathyroïdie secondaire au Cushing. L'une des principales fonctions de la parathormone étant la rétention urinaire du calcium et l'excrétion du phosphore, il apparaît plus probable que cette hyperparathyroïdie découle des déséquilibres du métabolisme du calcium induits par l'hypercortisolisme (mais ne la provoque pas). Ce serait donc la fuite urinaire de calcium qui stimulerait la sécrétion de parathormone. Entre autres, car le mécanisme serait plurifactoriel, au vu de l'absence de corrélation observée entre tous ces paramètres ici. Dans le cas d'une hyperparathyroïdie secondaire à l'hypercortisolisme (autre hypothèse envisagée), les auteurs rappellent qu'une hypercalcémie et une hypophosphatémie devraient être observées.
Le rôle de la vitamine D reste complexe à élucider. Les résultats observés ici confortent l'hypothèse que l'hydroxylation de la vitamine serait favorisée lors d'hypercortisolisme et de parathyroïdie associée, comme supposé chez l'homme. De même, la diminution du FGF-23 observée chez les chiens à Cushing pourrait jouer un rôle dans le développement d'une hyperphosphatémie (et potentiellement d'une hypophosphaturie).
21 août 2025
 4 min
4 min

20 août 2025
 4 min
4 min

19 août 2025
 4 min
4 min
18 août 2025
 5 min
5 min

14 août 2025
 4 min
4 min
12 août 2025
 6 min
6 min





