24 octobre 2025
 3 min
3 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


28 janvier 2020
Pour explorer le Cushing, Dechra obtient une AMM pour une ACTH de synthèse : le tétracosactide Cosacthen°
L'Agence nationale du médicament vétérinaire a accordé à Dechra le 19 décembre une AMM à une ACTH de synthèse, le tétracosactide : Cosacthen°. Cette solution injectable devrait succéder dans quelques mois à un médicament similaire, mais pas identique, jusqu'à présent accessible seulement sous ATU (autorisation temporaire d'utilisation) et qui n'était donc pas référencé en centrales.
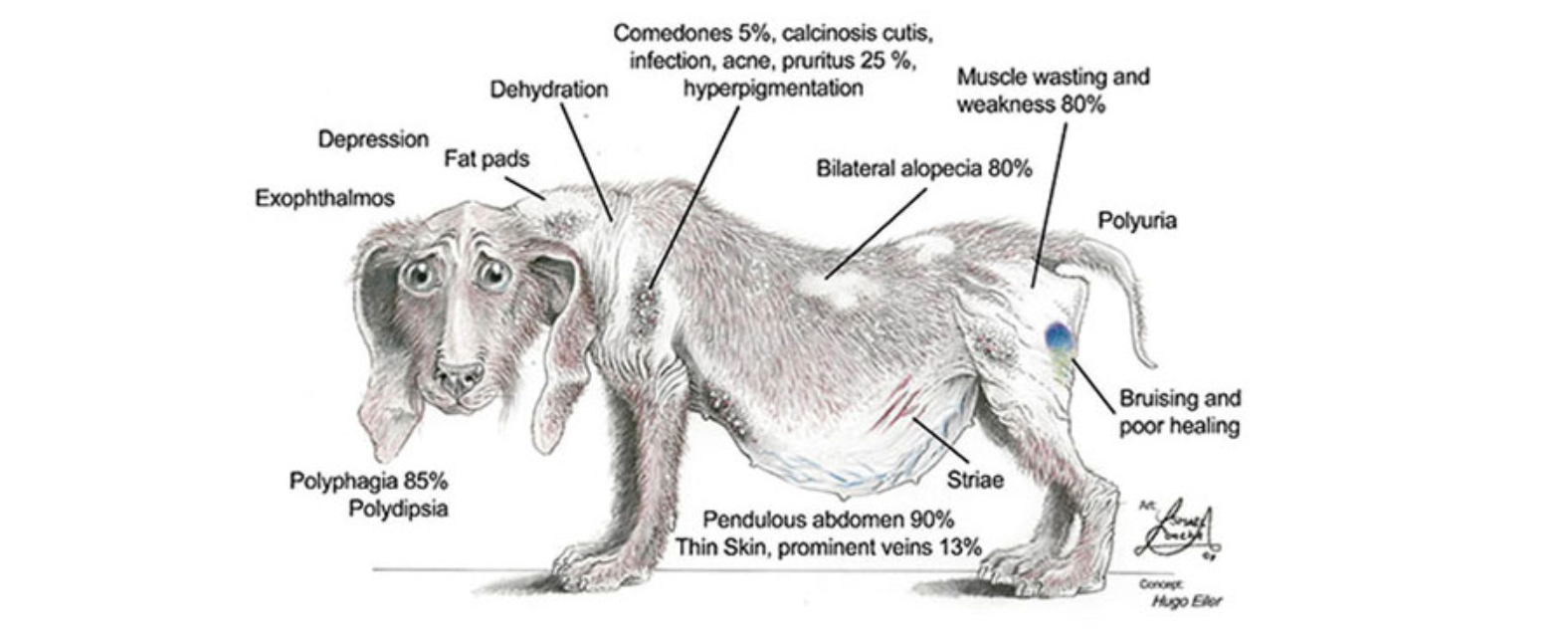
Développé par Dechra, Cosacthen° est donc le premier médicament avec une AMM vétérinaire à base de tétracosactide, l'analogue de synthèse de l'ACTH. Cette hormone hypophysaire « provoque la sécrétion de cortisol » par les surrénales. L'ACTH (ou le tétracosactide) est donc indispensable pour l'exploration de la fonction corticosurrénalienne, notamment le diagnostic d'un syndrome de Cushing (hypercorticisme).
Dechra dispose aussi des AMM pour des gélules de trilostane (Vetoryl°), le seul médicament vétérinaire destiné au traitement au long cours des hypercorticismes (Cushing) chez les chiens. Le test de stimulation à l'ACTH est aussi nécessaire pour ajuster la posologie de ce traitement.
Depuis mars 2014, Dechra bénéficie déjà d'une ATU pour une solution injectable à 0,2 mg/2 ml de tétracosactide. Cette ATU permettait aux vétérinaires de remédier aux ruptures prolongées de la spécialité humaine Synacthène° (0,25 mg/ml de tétracosactide). Mais le médicament sous ATU n'est pas référencé en centrale. Il convient de s'adresser directement à Dechra pour le commander. En fin d'année dernière, le tétracosactide vétérinaire de Dechra sous ATU était malheureusement en rupture, une rupture jugée critique par l'ANMV (voir ce lien) puisqu'il n'a aucun médicament équivalent disponible. Désormais le tétracosactide sous ATU est à nouveau disponible de manière à faire la jonction avec Cosacthen° lorsqu'il sera référencé en centrales.
Cosacthen° n'a pas tout à fait le même dosage que le tétracosactide sous ATU. Cosacthen° est présenté en flacon verre de 1 ml contenant 0,25 mg de tétracosactide. Dans l'ATU, 0,20 mg de tétracosactide sont dilués dans un flacon de 2 ml. Cosacthen° est donc 2,5 fois plus concentré que le tétracosactide sous ATU.
Le flacon fermé se conserve deux ans au réfrigérateur. Mais, il est à utiliser immédiatement après une première ponction. Aucun conservateur antimicrobien n'est présent dans les excipients de la solution injectable.
Ce médicament est indiqué chez les chiens (âgé de plus de 5 mois) pour l'« exploration de la fonction corticosurrénaliennes » selon le RCP officiel (résumé des caractéristiques du produit). Pour cela, la dose à injecter par voie IV ou IM est de 5 mcg/kg, soit 0,2 ml/10 kg. Le dosage du cortisol est réalisé 60 à 90 minutes après l'injection au moment du pic de la sécrétion du cortisol induite par l'ACTH. Une dose plus faible que 5 mcg/kg diminue la durée de la sécrétion de cortisol. Une dose plus élevée n'a pas d'effet sur la concentration maximale en cortisol. Le tétracosactide est, comme l'ACTH, rapidement métabolisé en moins de deux heures.
Le tétracosactide est contre-indiqué chez les femelles gestantes et, à utiliser avec précautions, en cas diabète ou d'hypothyroïdie.
Dans les études cliniques du dossier d'AMM, les effets indésirables ont été les suivants :
24 octobre 2025
 3 min
3 min

23 octobre 2025
 6 min
6 min

22 octobre 2025
 4 min
4 min

21 octobre 2025
 4 min
4 min

20 octobre 2025
 3 min
3 min
17 octobre 2025
 4 min
4 min
