5 septembre 2025
 4 min
4 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


6 mars 2019
NAC : le “virus X” est bien l'agent causal du syndrome rénal et de fragilité de la carapace des tortues terrestres juvéniles
L'équipe de la clinique NAC de l'université vétérinaire de Giessen (Allemagne) publie le résultat de l'inoculation expérimentale d'un picornavirus (jusque-là baptisé virus X) à des tortues terrestres et démontre ainsi son implication dans un syndrome d'insuffisance rénale et de fragilité de la carapace et du plastron.
Cette équipe avait déjà décrit en 2014 l'apparition de ce syndrome au sein d'une « collection privée de tortues » comportant plusieurs espèces de tortues terrestres (voir le tableau ci-dessous), dont l'auteur vendait la descendance, avant l'apparition du syndrome. Les auteurs préviennent qu'ils avaient auparavant écarté les causes connues d'amollissement de la carapace (insuffisance d'UVB, déséquilibre nutritionnel, administration d'acide oxalique, infection fungique) ou de néphropathie (hexamitose, infections bactériennes). Les juvéniles de tortue grecque (Testudo graeca) et de tortue étoilée d'Inde (Geochelone elegans) étaient alors particulièrement atteints, présentant des signes cliniques prononcés conduisant à une anorexie et une apathie, apparaissant juste avant le décès, 6 semaines après le début d'expression des signes cliniques. L'histologie identifiait une « glomérulonéphrite congestive » et « la prédominance de tissu fibreux sur la couche osseuse de la carapace, avec des plaques osseuses non imbriquées ». Cet épisode avait conduit à l'isolement d'un Picornavirus à partir d'écouvillons conjonctifs, pharyngés et cloacaux des sujets atteints. Les juvéniles des tortues de Hermann (T. hermanii) paraissaient alors épargnés, ainsi que les adultes de toutes les espèces (élevés en plein air « dans de bonnes conditions »). Toutefois, ce virus était également retrouvé chez des sujets sains de la même collection. Alors baptisé virus X, il est ensuite passé par la taxonomie internationale et devenu le Tortoise Picornavirus (TPoV).
Effectif de la collection privée de tortues terrestres où le syndrome a été identifié pour la première fois.* Cette espèce n'apparaît pas dans la description initiale de l'épisode, mais est mentionnée comme présente dans la collection dans la publication de 2019 (LeFil, d'après Heuser et coll., 2014 et Paries et coll., 2019).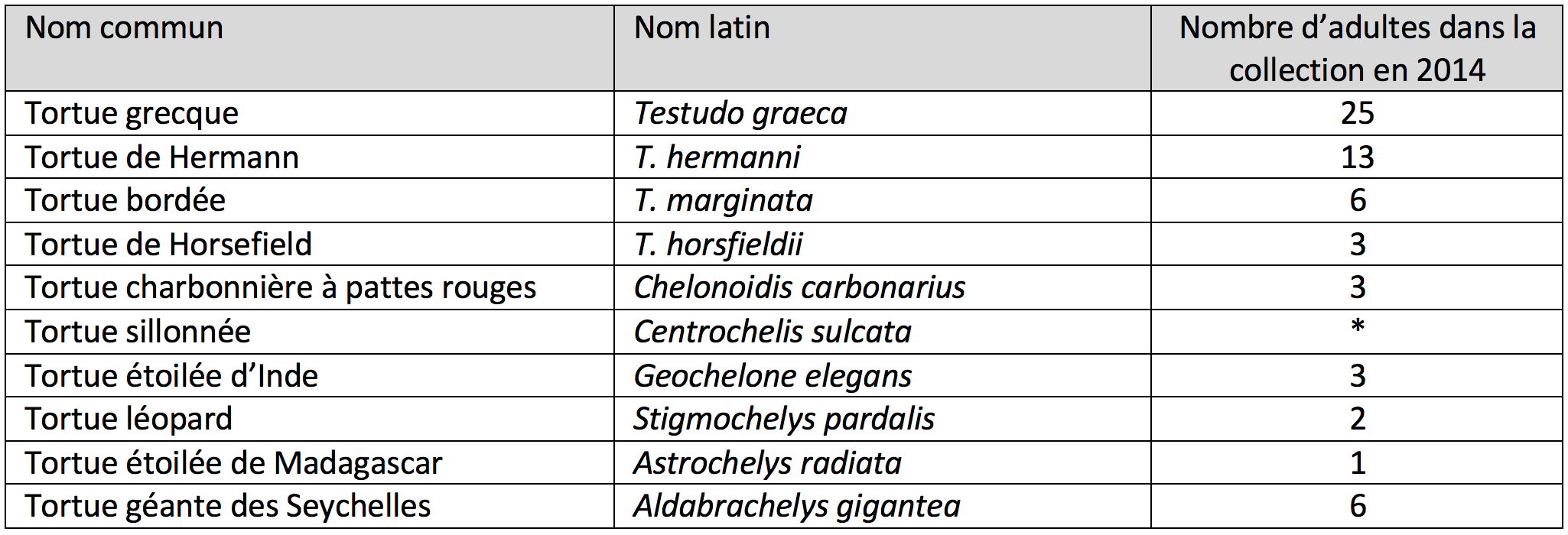
Douze juvéniles (2 à 14 jour d'âge) de chacune des deux espèces (tortue grecque et tortue de Hermann) ont été obtenus à partir de « collections particulières indemnes de ce virus ». Ils ont fait l'objet « d'analyses répétées » en RT-PCR et sérologie (trois fois à une semaine d'intervalle sur les sujets), pour valider leur statut indemne du TPoV. Puis 10 sujets de chaque espèce ont été inoculés par voies oronasale, intracloacale et intracœlomique (0,066 ml par chaque voie), avec une « dose infectante » de ce virus (2 000 TCID50 en tout). Deux sujets de chaque espèce ont été inoculés par du milieu de culture (témoins négatifs) et élevés à part. Tous étaient observés quotidiennement sur 6 mois (164 jours post-inoculation, PI), avec des pesées tous les deux jours et des prélèvements (écouvillons cloacaux et pharyngés) hebdomadaires.
Deux des tortues grecques inoculées se sont développées normalement jusque 90 jours PI, puis ont présenté un plastron amolli, phénomène s'étendant à la carapace sur les 30 jours suivants. Les auteur précisent qu'ils l'appréhendent en prenant la tortue entre le pouce et l'index et en appuyant légèrement : la carapace de déprime sous la pression. A partir de J120, les deux sujet ont réduit leur activité, perdu du poids et ont été anesthésiés à J155 après l'apparition d'anorexie et apathie. Sur 5 des autres tortues de ce groupe, la croissance était ralentie (81,7 % du poids moyen attendu) sur la durée de l'observation, mais sans signes cliniques (contre 149 % du poids moyen pour les deux témoins négatifs, p=0,0001). Les trois autres tortues grecques inoculés ont présenté un amollissement de la carapace autour de J100, qui a rétrocédé ensuite.
Une tortue de Hermann inoculée s'est développée normalement jusque J67 PI, devenant alors anorexique et apathique et présentant un ramollissement de la carapace ventrale, s'étendant progressivement en face dorsale (euthanasie à J105 PI). Cinq autres tortues de ce groupe ont présenté un net retard de croissance et de gain de poids (54 % du poids attendu, contre 149 % chez les témoins négatifs). Quatre autres sujets ont présenté un ramollissement limité et passager de la carapace.
Les tableaux nécropsiques et histologiques des trois tortues euthanasiées retrouvent les lésions déjà décrite lors de l'épisode initial signalé en 2014 : plaques osseuses et côtes non jointives, reins gonflés, hypertrophie de la vessie contenant des accrétions d'acide urique. Les lésions histologiques étaient plus limitées chez les sujets à simple retard de croissance. Tous les sujets inoculés ont été excréteurs fécaux du virus (RT-PCR) de manière intermittente entre J18 post-inoculation et la fin de l'étude (J164 PI). Ceux présentant des signes cliniques avaient une excrétion plus fréquente. Le génome viral a été détecté dans les organes internes de tous les sujets inoculés. Le virus a été ré-isolé à partir de 16 des 20 sujets inoculés (la langue semble être l'organe de choix pour mettre le virus en évidence) et 13 des 20 sujets avaient séroconverti. Les sujets ayant eu des signes passagers étaient ceux qui présentaient les titres en anticorps anti-TPoV les plus élevés. A l'inverse, les sujets euthanasiés étaient séronégatifs.
Pour ces auteurs, les postulats de Koch ont donc été respectés et le ToPV est bien l'agent étiologique du syndrome observé, sans qu'il y ait de différence de réceptivité entre les deux espèces de tortues. Ils calculent que pendant la période où le plastron et/ou la carapace sont ramollis, la probabilité de détection du virus est particulièrement élevée. Ils suggèrent aux praticiens impliqués dans les NAC de rechercher ce virus face à un ramollissement de la carapace de juvéniles de tortues terrestres, après avoir exclu les autres causes.
5 septembre 2025
 4 min
4 min

4 septembre 2025
 3 min
3 min
3 septembre 2025
 5 min
5 min

2 septembre 2025
 2 min
2 min

1er septembre 2025
 4 min
4 min

29 août 2025
 5 min
5 min