23 juin 2025
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


2 août 2018
Été meurtrier : la flunixine injectable disparaît du marché du fait d'un excipient cancérogène

37 ans. Un bel âge pour mourir ? Née en plein été ensoleillée, le 4 août 1981 — la température frôlait déjà les 30 °C —, la solution injectable de flunixine seule (Finadyne° injectable, MSD) ne fêtera pas, à quelques jours près, son 37ème anniversaire. Elle ne survivra pas à l'été caniculaire de 2018.
Pourquoi ? Car un de ses excipients, la diéthanolamine (DEA), une substance couramment utilisée par l'industrie chimique comme tensioactif et produit anticorrosion, que l'on croyait inoffensive jusqu'en 2013, a été inscrite dans la liste des « cancérogènes possibles ».
Après six mois de tergiversations européennes et de réévaluation, le 27 juillet 2018, l'Agence nationale du médicament vétérinaire (Anses-ANMV) a finalement notifié les suspensions des AMM de onze solutions injectables à base de diéthanolamine :
Ces suspensions d'AMM sont accompagnées d'un rappel de lot de tous les stocks détenus par les centrales et les dépositaires, mais pas de ceux détenus par les ayants droit. Les vétérinaires peuvent donc écouler leurs stocks. Mais, depuis quelques jours, il n'est plus possible aux laboratoires et aux centrales de les livrer d'une solution injectable à 50 mg/ml de flunixine seule (ou de Tribrissen° injectable).
Néanmoins, ces suspensions d'AMM ne concernent pas tous les médicaments à base de flunixine. Ni la nouvelle formulation pour-on de flunixine pour bovins (Finadyne° Transdermal), ni les solutions injectables associant la flunixine avec des antibiotiques (Resflor°, Finoxaline°, Covunil°) ne contiennent de diéthanolamine. Ils ne sont donc pas visés par ces suspensions d'AMM, même si Covunil° et Finoxaline° sont formulées avec un excipient très proche, la monoéthanolamine. Mais cet excipient n'est, à ce jour, pas suspect de cancérogénicité.
Ces décisions de l'agence française du médicament vétérinaire découlent d'un arbitrage défavorable de l'Agence européenne du médicament sur la cancérogénicité des résidus éventuels de cet excipient rendu seulement une semaine plus tôt, le 19 juillet 2018. Cinq autres agences nationales, le Royaume-Uni, les Pays-Bas, la Belgique, l'Espagne et la Finlande, sont alignées sur la position française et semblent avoir démarré les procédures de suspensions d'AMM. L'Irlande indique qu'elle réfléchit à des mesures de restriction mais sans confirmer explicitement si elle ira jusqu'à la suspension des AMM. L'Allemagne, l'Italie, le Danemark… n'ont pas encore fait connaître leurs positions. Il est néanmoins probable que ces pays soient aussi contraints, à court ou moyen terme, de suspendre les AMM des solutions injectables destinées aux bovins, aux porcins et aux chevaux.
Tout a commencé exactement six mois plus tôt, le 18 janvier 2018. Quand l'Agence européenne du médicament (EMA) décide de retirer la diéthanolamine (DEA) de la liste « out of scope » des excipients permis dans les productions animales, un des excipients utilisés dans les solutions injectables de flunixine seule. L'agence signifie ainsi qu'elle considère la DEA comme un cancérogène potentiel, ce qui rendrait impossible son emploi dans des médicaments destinés aux productions animales pour des questions de résidus.
À ce stade, ni la petite sœur de la diéthanolamine, la monoéthanolamine (MEA), ni son grand frère, le triéthanolamine (TEA), ne semblent être visés. Le TEA est d'ailleurs toujours inscrit dans la fameuse liste « out of scope » des excipients non soumises à la réglementation relative aux limites maximales de résidus (LMR). Sept médicaments vétérinaires destinés aux productions animales, dont trois pour-on pour bovins, en contiennent. En revanche, la MEA ne l'est pas. Elle entre pourtant dans la formulation d'une cinquantaine de médicaments pour la plupart destinés aux productions animales.
Entre la mi-janvier et la mi-mars, les États membres divergent sur les mesures à prendre à la suite du retrait de la diéthanolamine de la liste « ouf of scope ». Certains pays prônent le retrait immédiat des AMM avec rappel de tous les lots des médicaments concernés. À l'opposé, d'autres estiment que la réglementation n'impose pas de prendre de mesures d'urgence alors qu'il ne s'agit pas d'une substance active mais d'un excipient inactif couramment utilisé depuis 37 ans dans les solutions injectables de flunixine.
En France, les rumeurs d'un retrait brutal des solutions injectable sèment un début de panique sur le terrain (voir LeFil du 22 mars 2018).
C'est finalement la Belgique qui joue en touche. Le 14 mars, elle demande l'arbitrage de l'Agence européenne du médicament. Le 16 mars, l'agence européenne lance alors un appel aux industriels et à toute personne ou organisation pour lui faire parvenir avant le 14 mai toutes les données, même celles non publiées, sur la toxicité de la diéthanolamine, son métabolisme et ses éventuels résidus dans les denrées d'origine animale.
Combien de temps va durer cette évaluation de la toxicité des résidus de la diéthanolamine ? Plusieurs mois, voire un an ou deux, comme c'est souvent le cas dans ces procédures d'arbitrages complexes. Pas du tout. Deux semaines !
Tout va en fait très vite. Comme si les autorités étaient pressées de clore le dossier. Ou comme si le profil toxicologique de la diéthanolamine justifiait de prendre des décisions sans attendre. Peut-être de crainte que l'opinion publique et les médias puissent un jour reprocher aux autorités de n'avoir pas agi dans l'urgence. Le principe de précaution, qui a toujours bon dos, n'est-il pas si contestable sur le principe, mais si utile par précaution ?
Car le rapport d'arbitrage conclut qu'« il ne peut être exclu un risque toxicologique pour les consommateurs de denrées issues d'animaux qui auraient été traités par un médicament contenant la diéthanolamine ». Tout est dit. Rien n'est démontré. Rien n'est exclu. Donc tout doit être supprimé.
Dès le 1er juin, ce premier rapport d'arbitrage défavorable circule entre les experts. Il sera amendé et présenté dans une version préliminaire à la réunion du 19 juin du comité d'experts du médicament vétérinaire (CVMP) de l'agence européenne.
Dès le 10 juillet, le rapport final défavorable est envoyé aux États membres. Le 19 juillet, le rapport est officiellement adopté par l'agence européenne, puis publié six jours plus tard le 25 juillet.
Compte tenu de la cancérogénicité potentielle des résidus de cet excipient, le rapport d'arbitrage juge nécessaire de fixer des LMR à la diéthanolamine, puis de réaliser les études de déplétions des résidus pour s'assurer que ces LMR ne seraient pas dépassées. Autant d'exigences qui reviennent à faire disparaître rapidement du marché tous les médicaments existants à base de diéthanolamine.
La France ne prend d'ailleurs aucun délai supplémentaire avant de démarrer les procédures de suspension d'AMM. Dès le 20 juillet, une mise en demeure est adressée aux titulaires d'AMM, suivie, sept jours plus tard, le 27 juillet, de la notification officielle de suspension d'AMM avec rappel des stocks détenus dans les centrales.
Les suspensions (provisoires) d'AMM qui sont prononcés ne sont, en principe, pas des retraits (définitifs) d'AMM. Elles sont prises pour une période d'un an renouvelable. En théorie, ces suspensions provisoires d'AMM pourraient donc être levées si l'une des deux conditions suivantes est satisfaite.
La diéthanolamine (DEA) pourrait être remplacée par un autre excipient tensio-actif, comme la monoéthanolamine (MEA) ou le triéthanolamine (TEA). Mais cela nécessiterait au minimum de refaire un dossier qualité, voire des études bioéquivalence ou de tolérance le cas échéant selon la nature du nouvel excipient. En outre, la suspicion de cancérogénicité qui plane au-dessus de la DEA, pourrait, à terme, atteindre aussi sa petite sœur (la MEA) ou son grand frère (le TEA).
Un industriel pourrait aussi envisager de déposer un dossier de fixation de LMR de la diéthanolamine avec des études de déplétion de résidus (viandes et lait) en vue, in fine, de déterminer de nouveaux temps d'attente adaptés. Cette hypothèse est sans doute la moins probable compte tenu des lourds investissements qui seraient nécessaires pour de telles études, avec un risque, in fine, de ne pas réussir à aboutir à la fixation de LMR si des métabolites génotoxiques sont identifiés.
Chez les bovins, les porcins ou les équins, la flunixine représente sans doute entre un tiers et la moitié du marché des AINS injectables. Son retrait brutal n'est donc pas facile à gérer.
Déjà les vétérinaires équins britanniques se mobilisent pour demander son maintien pour les chevaux exclus de la consommation humaine. Mais dans l'UE, ce maintien n'est possible qu'en l'absence d'autres AINS injectables chez les équidés. À ce jour, au moins trois AINS sont approuvés chez les équidés dans des formes injectables : le méloxicam (Metacam° et génériques), le firocoxib (Equioxx°) et le kétoprofène (Ketofen° et génériques). Il sera très difficile de justifier de la nécessité de conserver la flunixine face à des AINS concurrents dont les LMR des excipients ne semblent pas poser de problème.
De même chez les bovins et les porcins, trois ou quatre AINS injectables sont disponibles, avec parfois de nombreux génériques comme pour le méloxicam (Metacam°). Le défi sera donc surtout d'éviter le retrait brutal de la flunixine injectable conduisent à des ruptures en cascade chez les AINS concurrents.
Le tableau ci-dessous présente brièvement ces AINS injectables pouvant apparaître comme des alternatives à la flunixine. Les résumés officiels des caractéristiques de ces produits (RCP) diffèrent parfois entre le princeps et les génériques, notamment sur le libellé des indications, ainsi que, plus rarement, sur les temps d'attente. Toutes ces nuances ne sont pas reproduites dans le tableau ci-dessous.
Tableau des alternatives à la flunixine injectable
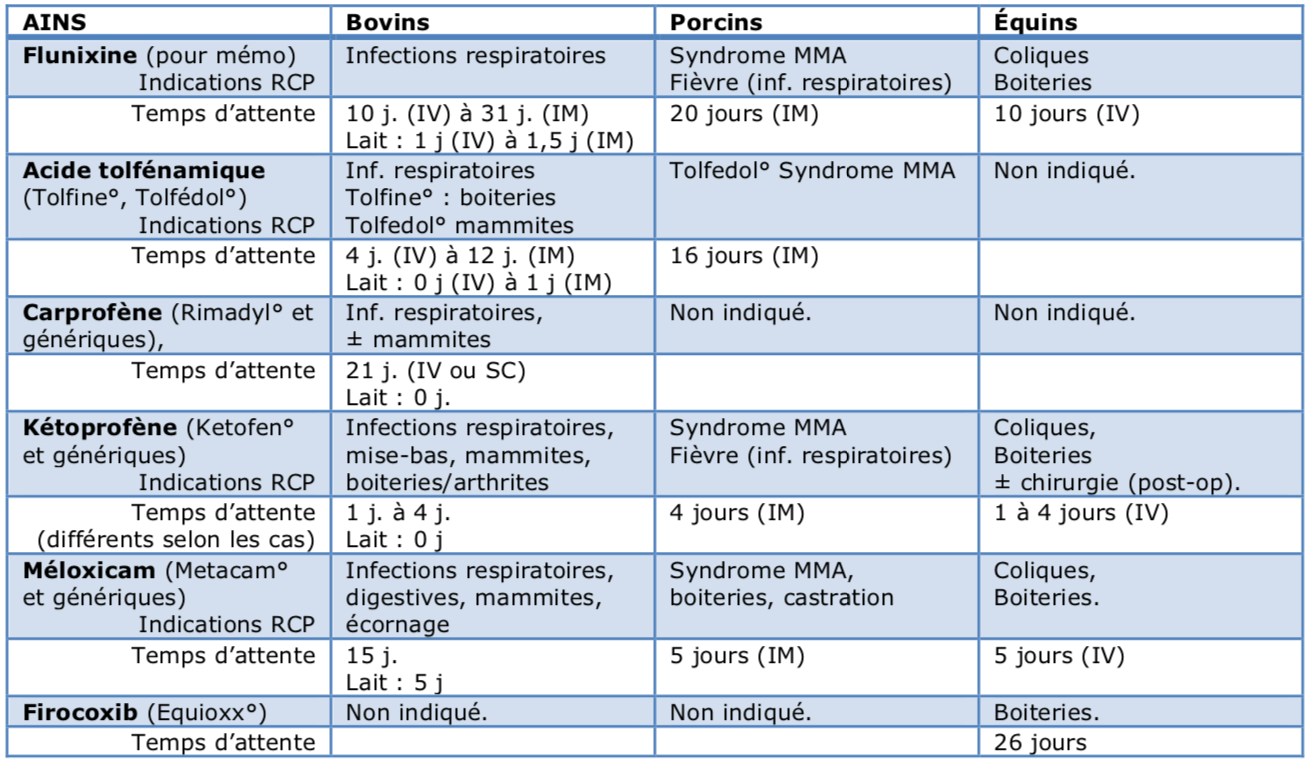
Tableau LeFil d'après les données des résumés officiels des caractéristiques des produits (RCP) sur le site de l'Anses-ANMV.
Chez les bovins, la solution pour-on de flunixine (Finadyne° Transdermal) est aussi une alternative envisageable. Ses temps d'attente sont de 36 heures dans le lait et 7 jours dans les viandes.
23 juin 2025
 4 min
4 min

20 juin 2025
 5 min
5 min

19 juin 2025
 4 min
4 min

18 juin 2025
 6 min
6 min

17 juin 2025
 3 min
3 min
16 juin 2025
 4 min
4 min
