30 mai 2025
 2 min
2 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


22 mars 2018
Comment la flunixine injectable a échappé de peu à un retrait brutal de ses AMM
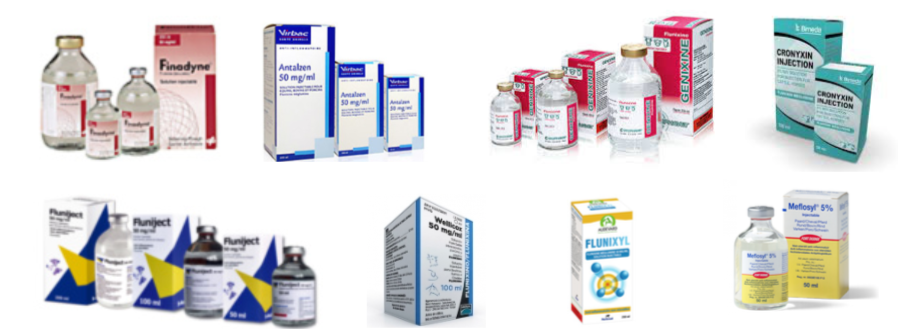

Début mars, des rumeurs d'un arrêt imminent de la commercialisation de toutes les solutions injectables de flunixine se sont vite répandues sur le terrain. Aujourd'hui, la menace semble écartée à court terme, pour au moins les prochains mois. Mais, à long terme, le maintien de ces formulations injectables n'est pas assuré. Explication : toutes les formulations de solutions injectables de flunixine incluent un excipient, la diéthalonamine, aujourd'hui suspectée de génotoxicité et cancérogénicité.
Tout commence le 18 janvier dernier. L'Agence européenne du médicament (EMA) décide alors de retirer de la liste des excipients permis dans les productions animales, la diéthalonamine (DEA), un des excipients utilisés dans les solutions injectables de flunixine seule. Ce solvant est désormais considéré par comme génotoxique ou cancérogène potentiel, contrairement à sa petite sœur, la monoéthalonamine (MEA), ou son grand frère, le triéthalonamine (TEA). Ce dernier est d'ailleurs toujours inscrit dans cette fameuse liste des substances non soumises à la réglementation relative aux limites maximales de résidus (LMR) : la liste dite « out of scope ».
Cette liste de six pages comprend notamment de nombreux excipients utilisés dans les médicaments destinés aux productions animales ou quelques substances inoffensives en termes de résidus, comme l'oxygène (!), l'eau, le miel, l'avoine, les céréales, les immunoglobulines etc. (voir ce lien).
Mais l'inscription à cette liste n'est pas une obligation réglementaire pour les excipients « inactifs ». La liste n'est donc pas exhaustive : certains excipients ne figurent pas dans cette liste. Seules les substances dites « pharmacologiquement actives » sont soumises à l'obligation de fixation d'une LMR avant l'octroi d'une AMM ou même son usage « hors AMM ». Les LMR des excipients inactifs ne sont donc pas exigées, ni même leur inscription à la liste « ouf of scope ».
À partir du mois de février, les États membres divergent sur les mesures à prendre suite au retrait de la diéthalonamine de la liste « ouf of scope ».
De telles décisions ne peuvent pas être prises à la légère sans une évaluation sérieuse de leur impact sur la santé animale. En France, une dizaine de médicaments injectables destinés aux productions animales sont formulés avec de la diéthalonamine.
Partout en Europe, le retrait des médicaments contenant la diéthanolamine impacterait surtout l'usage de la flunixine injectable chez les bovins, les porcins et les équins. Cet AINS représente sans doute entre un tiers et la moitié du marché des AINS injectables dans ces trois espèces, voire peut-être encore davantage dans certains marchés.
Certes, de nombreuses alternatives à la flunixine injectable sont disponibles avec de multiples AINS injectables autorisés et commercialisées dans des gammes princeps et génériques, comme le méloxicam (Metacam°…), le kétoprofène (Ketofen°…), le carprofène (Rimadyl°…), l'acide tolfénamique (Tolfine°…), voire chez les seuls équidés, le firocoxib (Equioxx°). Néanmoins, compte tenu du poids de la flunixine injectable dans le marché des AINS chez les bovins, les porcins et les équins, son retrait brutal et immédiat aurait pu générer une pénurie d'AINS analgésiques et, plus grave encore, beaucoup de souffrance animale. Les décisions prises au nom du principe de précaution se devaient aussi de tenir compte de cet impact mal évalué.
Dans ce débat, ce sont finalement les autorités belges qui ont le dernier mot. Début mars, elles décident de renvoyer la « patate chaude » à l'Agence européenne du médicament. Car en décidant, le 18 janvier dernier, de retirer la diéthalonamine de la liste « out of scope », l'Agence n'a pas procédé au préalable à une évaluation sérieuse de l'éventuel danger de ses résidus pour le consommateur. Et l'Agence n'a d'ailleurs pas recommandé l'interdiction de cet excipient dans des médicaments destinés aux productions animales… La Belgique demande donc cette évaluation avant de prendre des décisions lourdes de conséquences. La réflexion l'emporte donc sur le principe de précaution.
Le 16 mars, l'Agence européenne du médicament a donc débuté une procédure d'arbitrage sur « l'évaluation du risque pour le consommateur de l'usage de la diéthalonamine comme excipent de médicaments destinés aux productions animales ». Mais comme l'Agence ne dispose pas d'informations toxicologiques sur cet excipient, elle lance un appel public à la communication de ces données auprès de toutes les parties intéressées : industriels, sociétés savantes, centres de recherche, établissements publics, etc.
Les données requises par l'Agence devraient porter sur la toxicité de la diéthalonamine (cancérogénicité et génotoxicité), sur son métabolisme et ses résidus éventuels dans les denrées animales. Ces contributions devraient être transmises avant le 14 mai 2018 de préférence en anglais. Mais toute contribution dans l'une des langues officielles d'un pays de l'UE28 sera acceptée.
Le rapport d'évaluation sera ensuite préparé par un rapporteur et un co-rapporteur avant d'être discuté, puis adopté si possible par consensus — cela ne sera sans doute pas rapide — et, enfin, rendu public.
Cet arbitrage écarte, au moins provisoirement, la menace d'un retrait du marché de l'ensemble des solutions injectables de flunixine. Car la procédure d'arbitrage, quelle qu'en soit sa conclusion, favorable ou défavorable, prendra du temps, au moins plusieurs mois, peut-être davantage, avant une application sur le terrain d'éventuelles restrictions… Cela laisse donc le temps aux acteurs d'anticiper d'éventuelles recommandations défavorables.
Ce délai peut être mis à profit par les industriels pour modifier leurs formulations et donc leurs dossiers d'AMM. La diéthalonamine pourrait être remplacée par la triéthalonamine qui n'est pas suspectée de la même cancérogénicité, ou par un autre solvant. Mais si ce solvant a un effet sur la biodisponibilité de la flunixine, il conviendrait, en théorie tout du moins, de vérifier la bioéquivalence avec les anciennes formules… Cette substitution n'est donc pas une solution facile ni rapide à mettre en œuvre.
30 mai 2025
 2 min
2 min

28 mai 2025
 5 min
5 min

27 mai 2025
 4 min
4 min

26 mai 2025
 6 min
6 min






23 mai 2025
 4 min
4 min

22 mai 2025
 4 min
4 min
