2 mai 2024
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


Au 2 janvier 2017, il y a toujours 150 références de médicaments en rupture dans les centrales. Durant toute l'année 2016, le nombre de ruptures n'a jamais régressé. Au contraire, la tendance reste globalement à la hausse. De même, en 2016, le nombre de rappels de lots n'aura sans doute jamais été aussi élevé. L'année s'est d'ailleurs terminée par un dernier rappel de lots sur les comprimés Megecat° (Vétoquinol) à base d'acétate de mégestrol (lot N° 6C19006, fabriqué en juin 2016 pour une péremption en juin 2019).
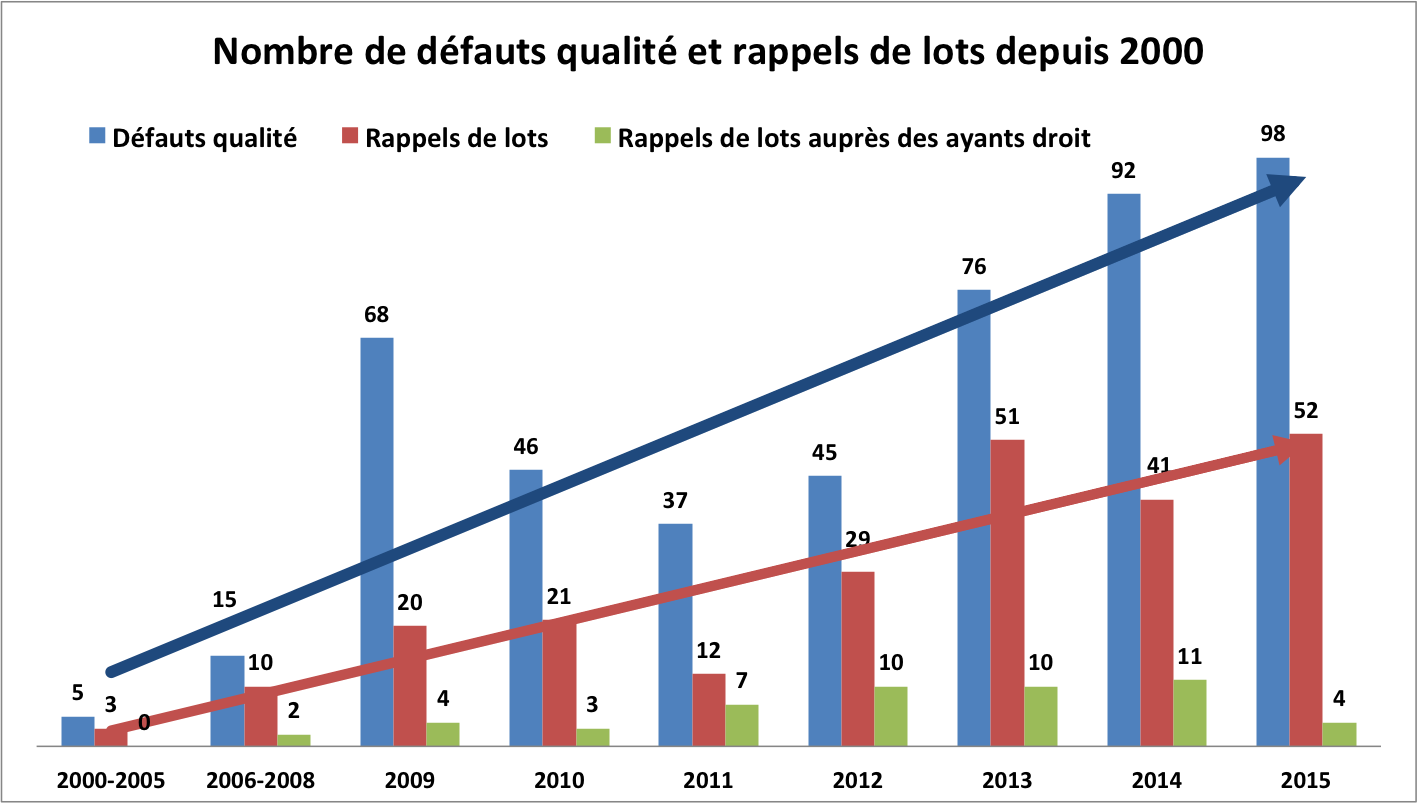
L'Agence nationale du médicament vétérinaire vient de publier son premier bilan annuel sur les défauts qualité, les rappels de lots, les ruptures et plus généralement tout le suivi post-AMM de l'année 2015. Même s'il y a une année de décalage dans la parution, la situation peut paraître inquiétante, alarmante même, si l'on ne regarde que les chiffres de 2015 : 98 défauts qualité, 52 rappels de lots et 83 ruptures déclarées.
Les défauts qualité concernent désormais une centaine de médicaments par an. Plus de la moitié d'entre eux provoquent des rappels de lot. Avant 2005, des problèmes étaient quasi-inexistants ou exceptionnels. Entre 2000 et 2005, seulement 5 défauts qualité ont été constatés sur ces six années, dont trois rappels de lots. Un tous les deux ans, au lieu d'un par semaine aujourd'hui.
Les médicaments ne sont évidemment pas de moins de bonne qualité aujourd'hui qu'en 2005. Mais ce sont les contrôles qualités qui se sont (trop ?) renforcés, pouvant laisser croire, sans doute à tort, qu'on était beaucoup plus laxiste en 2005 qu'en 2015.
Le tournant a lieu en 2010 avec la mise en place des études dites de « stabilité en continu ». Jusqu'en 2009, les laboratoires se contentaient de conserver des échantillons de chacun des lots de médicaments jusqu'au moins la fin de péremption. Après le contrôle du produit fini, ces échantillons étaient conservés sans être analysés sauf en cas de problème sur le terrain. En 2010, il est devenu obligatoire de contrôler « en continu », tous les trois mois, la stabilité des médicaments en cours de commercialisation (non périmés) sur au minimum un lot par an. En pratique, la quasi-totalité des lots en cours de commercialisation sont ainsi contrôlés tous les trois mois.
Immédiatement après fabrication, la teneur en principe actif ne devrait pas varier de plus de 5 % et ainsi rester dans la norme 95-105 % dans le cas général. En fin de péremption, plus de 90 % ou 95 % de la substance active devrait toujours être présente.
À partir de 2010, les contrôles de stabilité « en continu » ont provoqué une première explosion de nombre de rappels : jusqu'à 30 rappels de lots durant l'année 2012. Puis en 2013, un nouveau renforcement de ce contrôle conduit à franchir un nouveau pallier : un rappel de lots par semaine en 2015 en moyenne.
Une teneur insuffisante en principe actif, révélée par ces dosages en continu, est la cause de près d'un défaut qualité sur deux (46 %) en 2015 (versus 41 % en 2014), et, sans doute de la plupart des rappels de lots. Dans 90 % des cas, ces rappels de lots s'arrêtent aux stocks détenus par les grossistes. Ils ne vont pas souvent jusqu'aux vétérinaires ni a fortiori jusqu'aux propriétaires d'animaux.
Mais, dans presque tous les cas, ils génèrent des ruptures. Car les stocks prévus dans les centrales pour répondre aux besoins des vétérinaires ne sont plus disponibles. Avant de prendre la décision du rappel d'un médicament, l'Agence nationale du médicament vétérinaire essaye de tenir compte du risque, pour la santé animale, de sa rupture, notamment de la présence d'alternatives concurrentes. Mais la rupture d'un médicament leader sur son marché peut aussi conduire, par ricochet, à la rupture ses concurrents qui n'avaient pas anticipé le retrait forcé du leader.
Un tel constat interpelle. Le plus souvent, les médicaments concernés sont anciens. Leurs méthodes de dosage, voire les process de fabrication ou les conditions de conservation, nécessitent d'être réactualisées. En d'autres termes, ils ne sont plus aux normes. Ainsi, toutes les suspensions injectables de « Péni-Strepto » doivent désormais être conservées au réfrigérateur. Car, à température ambiance, la pénicilline G se dégrade plus vite que ne le prévoyait la durée initiale de conservation.
Si les problèmes de stabilité ne sont pas expliqués et résolus rapidement, les ruptures se prolongent Et cela peut même conduire à des suspensions d'AMM dans l'attente de nouvelles études de stabilité (aussi longues que la durée de conservation revendiquée !), voire à des abandons de fabrication.
Les teneurs trop faibles en principes actifs ne sont pas les seuls défauts qualité constatés. Entre un quart et un tiers des problèmes (28 % en 2015, 32 % en 2014) sont associés à des mesures administratives d'AMM, principalement des temps d'attente allongés ou des retraits d'indications. Les erreurs matérielles, dans l'étiquetage et les notices, représentent environ 10 % des défauts qualités (12 % en 2015, 10 % en 2014). Mais ces erreurs ne représentent pas un risque grave d'inefficacité ou de toxicité pour les animaux traités.
Les autres défauts qualités sont plus rares, mais aussi souvent plus graves. Des cas de contamination chimique ou microbiologique ont été décelés en 2015 (un cas) comme en 2016 (un cas). Les remontées de cas graves de pharmacovigilance ont conduit à moins de trois rappels de médicaments en 2015 comme en 2016. Dans de tels cas, les rappels de lots s'étendent jusqu'aux stocks détenus par les vétérinaires. Car le médicament est considéré comme trop dangereux pour continuer à être utilisé.
Indépendamment des rappels de lots, le nombre croissant de ruptures a conduit l'Agence du médicament vétérinaire à mettre en place en mars 2015 un recensement des ruptures effectives sur toutes les présentations d'un même médicament ou des risques avérés de telles ruptures.
Depuis mars 2015, l'Agence du médicament vétérinaire enregistre en moyenne 6,7 nouvelles ruptures par mois sur toutes les présentations d'un même médicament. Données Anses-ANMV.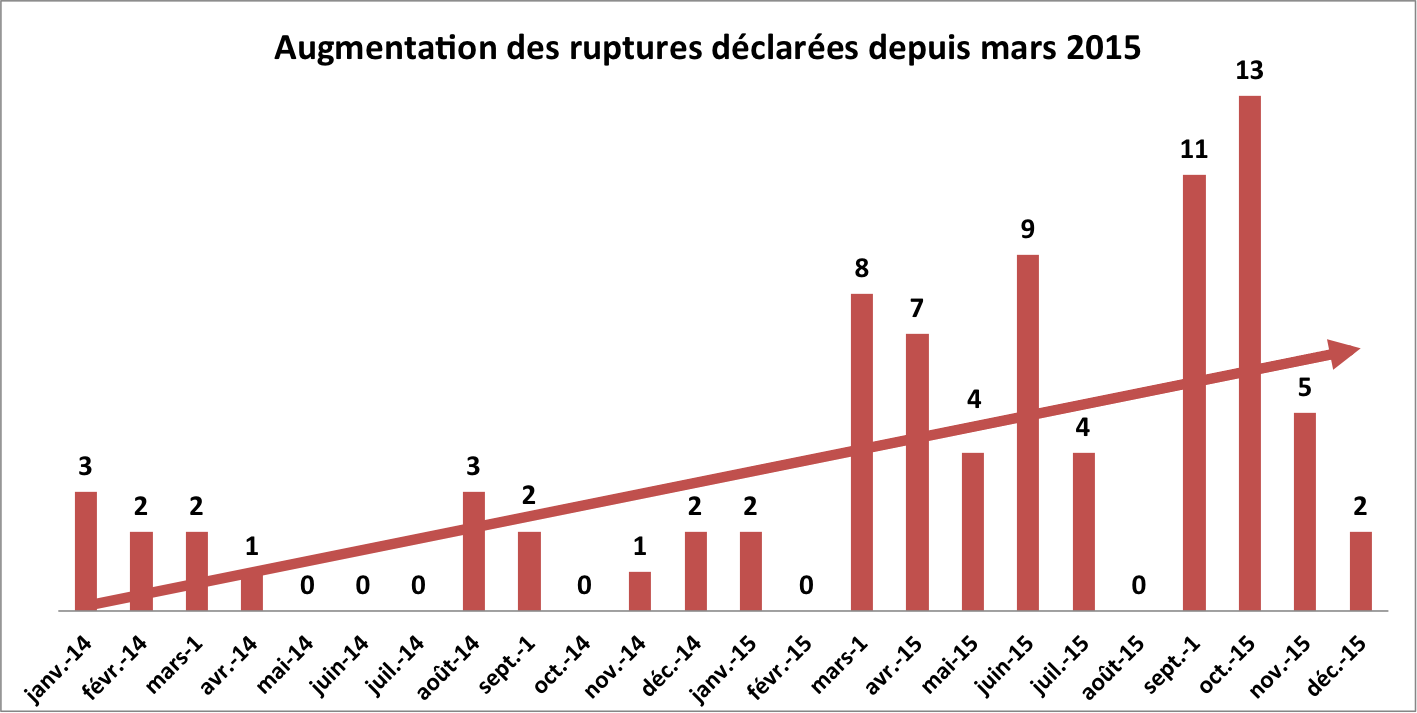
Avant mars 2015, les ruptures étaient très rarement déclarées à cette agence : entre zéro, une ou deux nouvelles ruptures par mois. Depuis, la moyenne est de 6,7 nouvelles ruptures déclarées chaque mois. Dans les centrales, ce sont environ 150 références commerciales qui sont en permanence en rupture, les deux tiers pour une durée « indéterminée ».
Sur les 83 ruptures déclarées en 2014 et 2015, 59 (71 %) concernent des vaccins (41 %) ou des antibiotiques (30 %). En 2016 comme aux premiers jours de 2017, de nombreux antibiotiques injectables (non critiques) sont en rupture dans la plupart des laboratoires qui les fabriquent. Mais l'Agence considère que la situation est la plus difficile pour les vaccins. Car les alternatives génériques sont inexistantes ou peu nombreuses. L'ANMV tente alors d'identifier avec les laboratoires et les vétérinaires des solutions comme l'octroi d'autorisations exceptionnelles d'importation pour des vaccins sans AMM en France.
La hausse des défauts qualité, des rappels de lot et des ruptures apparaît continue et surtout inéluctable, en médecine vétérinaire comme en pharmacie humaine. Elle n'en est pas pour autant acceptable dans les deux médecines. Surtout que les causes sont connues.
Mais peut-on remettre en cause tout à la fois les normes pharmaceutiques, la mondialisation des échanges et la libre concurrence ? Évidemment non ! Un meilleur compromis peut sans doute être recherché pour tenir compte, non seulement des normes, mais aussi des besoins vitaux en médicaments.
Pour terminer sur une note plus positive, l'Agence n'a décelé, chez les grossistes, aucun médicament vétérinaire contrefait ou falsifié. Sur ce point, elle prévoit de s'intéresser aussi, à l'avenir, aux sites de vente en ligne de médicaments vétérinaires qui approvisionnent les circuits illégaux.
Autre point positif, sur les 54 médicaments prélevés chez des grossistes, les six non-conformités (11 %) détectées sont, semble-t-il, mineures, trois sur la sécabilité des comprimés, deux sur « l'uniformité de la dose délivrée », et une sur le pH d'une solution.
Le contrôle de l'étiquetage de 126 spécialités a décelé 25 non-conformités, soit un taux de 20 % ! Mais la quasi-totalité de ces écarts à une réglementation parfois complexe étaient mineurs.
L'Agence examine les publicités qui devraient toutes lui être déposées préalablement à leur diffusion. Sur les 809 publicités déposées pour des médicaments en 2015, trois ont été refusées : une publicité comparative, des témoignages de prescripteurs (interdits pour les médicaments) et un support de publicité non conforme.
En 2014, elle a aussi interdit des publicités associées à l'organisation d'un concours, d'une bourse, ou à une opération de vente-partage au profit d'une association caritative. Une telle interdiction a aussi été prononcée en 2016.
Tournons donc vite la page de 2016. Et meilleurs vœux pour 2017.
2 mai 2024
 4 min
4 min

30 avril 2024
 5 min
5 min

29 avril 2024
 6 min
6 min

26 avril 2024
 5 min
5 min
25 avril 2024
 4 min
4 min

24 avril 2024
 4 min
4 min
