1er août 2025
 3 min
3 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


2 novembre 2015
La cabergoline au tarissement et une cytokine (immunostimulant) au vêlage
L’Agence européenne du médicament a aussi approuvé la levée de la suspension d’AMM de Closamectin° Pour on, sous réserve de l’application de nouvelles précautions d’emploi. Les avis de cette agence seront transposés en décisions dans les prochains mois.

Les nouvelles classes thérapeutiques vétérinaires sont rares. Encore plus exceptionnelles pour la filière bovine. Hasard du calendrier, le Comité vétérinaire de l’Agence européenne du médicament a approuvé, à la même réunion, deux nouveaux médicaments injectables sans aucun équivalent dans l’arsenal thérapeutique existant pour les vaches laitières :
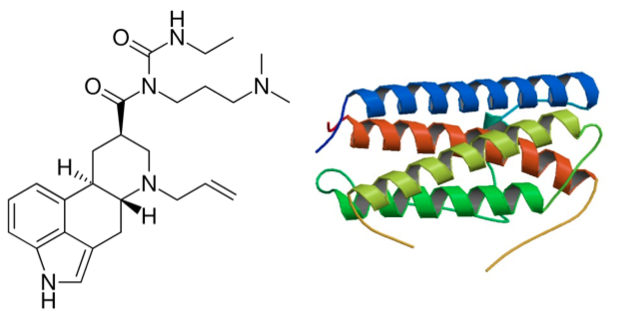
Ceva est à l’origine du développement de la solution injectable à 1,12 mg/ml de cabergoline (Velactis°) pour le tarissement des vaches. La cabergoline, à l’origine un dérivé de l’ergot de seigle (d’où son nom), est un agoniste dopaminergique (récepteurs D2). Son mode action conduit à une inhibition de la sécrétion de prolactine et, par conséquent, de la production laitière, induisant ainsi le tarissement.
La cabergoline est déjà indiquée pour le tarissement des chiennes sous la forme d’une solution buvable à 50 mcg/ml (Galastop°, Ceva). L’indication chez les vaches laitières est inédite. Le résumé de l’Agence européenne l’a décrit comme une « aide au tarissement (brutal) dans les programmes de management de troupeau ». Utilisée dans de tels programmes, la cabergoline « réduit aussi le risque de nouvelles infections mammaires pendant le tarissement, ainsi que les « fuites » de lait ».
Velactis° est déjà commercialisé par Ceva au Brésil. Dans ce pays, il se présente sous la forme de flacons de 5, 25 et 50 ml. La solution injectable s’administre par voie intramusculaire après la dernière traite à la dose de 5 ml par vache (soit 5,6 mg de cabergoline). Son temps d’attente dans le lait est de « zéro jour ».
Autre nouveauté sans précédent pour les vaches laitières : Imrestor°, des seringues unitaires préremplies d’une solution injectable de pegbovigrastim.
Ce nouveau médicament original est indiqué au moment du vêlage chez les vaches laitières pour « restaurer l’immunité » (d’où son nom commercial). Car, à partir d’une semaine avant le vêlage et durant quelques semaines après, les capacités immunitaires de la vache sont diminuées avec, notamment, une diminution des neutrophiles.
Le pegbovigrastim est un dérivé (conjugué) d’une cytokine naturelle qui stimule la fonction immunitaire par l’augmentation du nombre de neutrophiles.
Cette cytokine est appelée en anglais « granulocyte colony stimulating factor ou G-CSF » ou, en français, « facteur de stimulation de la lignée granulocytaire » (spécifique aux polynucléaires neutrophiles) ou « leucocytaire ». Ces cytokines G-CSF sont des glycoprotéines qui diffèrent légèrement selon les espèces. Ainsi, des médicaments humains, à base de la cytokine de l’homme (le lénograstime ou hG-CSF ou son dérivé méthylé appelé filgrastime ou methG-CSF) sont autorisés en France depuis 2013 pour corriger les neutropénies.
Avec 174 acides aminés, cette cytokine bovine est donc le bovigrastim : « bovi » pour bovin et « grastim » pour G-CSF (« stimule les granulocytes » ou neutrophiles). La demi-vie des cytokines naturelles est courte.
Le pegbovigrastim est une forme dérivée conjuguée ou « pégylée ». Cette conjugaison permet d’éviter une dégradation trop rapide de la cytokine. Sa durée d’action s’en trouve ainsi allongée. Le pegbovigrastim est donc synonyme de « pegylated bovine granulocyte colony stimulating factor » (peg bG-CSF ou pbG-CSF).
L’Agence européenne a approuvé Imrestor° pour « restaurer la fonction neutrophile normale durant le péripartum en vue de réduire la sensibilité de la vache aux mammites cliniques ». La baisse de l’immunité durant le péripartum rend en effet la vache plus sensible aux infections du post-partum, les mammites entre autres.
Les LMR (limites maximales de résidus) de cette cytokine ont été officiellement fixées en 2012. « Aucune LMR quantitative n’est requise » du fait, entre autres, de sa structure protéique. Les temps d’attente seront donc de « zéro jour ».
Imrestor° est déjà autorisé en Nouvelle-Zélande. Le protocole prévoit alors deux injections SC, la première une semaine avant la date prévue du vêlage et la seconde le jour du vêlage.
Le 6 juillet 2015, la France a suspendu l’AMM du pour-on bovin Closamectin° à base de closantel et d’ivermectine distribué en France par Merial à la suite de cas de pharmacovigilance graves mais rares : moins d’un cas mortel pour 10 000 bovins traités. L’Agence européenne a ensuite débuté une procédure d’arbitrage d’urgence à la demande de la France. Après avoir entendu les explications du titulaire de l’AMM (Norbrook), l’Agence considère que le rapport bénéfice risque reste favorable à la condition d’ajouter des précautions d’emploi dans la notice et le RCP (résumé des caractéristiques du produit). Avec ces nouvelles mises en garde, la levée de la suspension d’AMM en vigueur en France est donc recommandée.
La gentamicine a pour le moment des LMR fixées seulement chez les bovins et les porcins. La Commission européenne a saisi l’Agence européenne sur les extrapolations envisageables des LMR de cet aminoside couramment utilisé dans de nombreuses autres espèces animales. À la suite de cette demande, l’Agence a approuvé une extrapolation des LMR de la gentamicine à tous les mammifères et à toutes les espèces de poissons consommables.
Cette extrapolation ne conduit pas à modifier les LMR quantitatives : 50 mcg/kg dans la viande et la graisse, 200 mcg/kg dans le foie, 750 mcg/kg dans les reins (sans doute du fait de l’affinité des aminosides pour les reins) et 100 mcg/kg dans le lait.
Tous ces avis de l’Agence européenne du médicament ne sont pas d’application immédiate. Ils nécessitent d’être transformés en décisions par la Commission européenne, le plus souvent dans un délai de 90 jours pour les nouvelles AMM. En outre, les laboratoires ont parfois besoin de davantage de temps avant de commercialiser de nouveaux médicaments, ne serait-ce que adapter les outils industriels à ces nouveaux produits. Les dates d'AMM sont donc rarement les dates de lancement.
1er août 2025
 3 min
3 min

31 juillet 2025
 5 min
5 min
29 juillet 2025
 6 min
6 min

28 juillet 2025
 4 min
4 min

25 juillet 2025
 5 min
5 min

24 juillet 2025
 4 min
4 min