23 décembre 2025
 5 min
5 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


25 octobre 2018
Le règlement médicament vétérinaire adopté aujourd'hui à Strasbourg. La cascade y devient presque un lac


Aujourd'hui 25 octobre à midi, le Parlement européen a adopté par un vote à une large majorité (583 voix pour, 16 contre), le nouveau règlement européen « médicament vétérinaire ». La version initiale de ce projet datait de septembre 2014.
Ce projet fait aujourd'hui consensus après quatre ans d'intenses négociations entre une poignée d'eurodéputés, les fonctionnaires de la Commission européenne et les nombreuses délégations des gouvernements des 28 États membres de l'UE.
Ces négociations ont abouti à faire gonfler ce texte de 125 pages à 210 pages, de 150 articles à 250 articles. Si ce texte fait consensus, c'est qu'il ne tranche pas dans le vif des sujets les plus difficiles. Mais il permet, à travers des textes d'application, à chaque État membre de conserver ses spécificités nationales. Il devrait donc faire l'unanimité. Car chacun peut y voir midi à sa porte.
Ce règlement sera applicable dans l'UE à 27, sans transposition en droit national, trois ans et 20 jours après sa publication au Journal officiel de l'Union européenne attendue d'ici la fin de l'année 2018. L'application sera donc sans doute pour la fin 2021 ou le tout début de l'année 2022. Trois ans, c'est finalement assez court. Car, loin de clore cette refonte totale de la législation sur la pharmacie vétérinaire, ce texte ouvre, à l'inverse, de nombreux chantiers. De multiples, sans doute plusieurs dizaines de textes d'application et d'adaptation seront nécessaires à sa mise en œuvre fin 2021.
En France par exemple, l'application de ce règlement nécessitera au moins un projet de loi (ou une ordonnance législative) et des décrets et arrêtés d'application. Il s'agira d'abord d'éviter que le droit national doublonne ou s'écarte ou même s'oppose au texte européen. Si c'était le cas, le droit européen primerait sur le droit national, mais cela placera les différents acteurs dans une insécurité juridique.
Il s'agira aussi de faire les choix politiques que ce texte rend possible. Si un État membre permet le déconditionnement au détail des comprimés, il devra l'encadrer dans son droit national. À défaut, cela ne sera plus permis comme c'est le cas aujourd'hui en France. De même, les ventes en ligne au détail de médicaments sur prescription seront interdites, sauf si un État membre décide de les autoriser sur son (seul) territoire. Les trois prochaines années ne seront pas trop longues pour se préparer à cette nouvelle échéance.
Point important, ce règlement ne sera pas celui du découplage. Les État membres peuvent choisir de confier la vente au détail des médicaments à des vétérinaires — l'ayant droit dominant dans 22 pays sur 28 — ou, plus rare, exclusivement à des pharmaciens (voir LeFil du 19 juin 2018).
L'Europe se dote aussi pour la première fois d'une sorte de plan EcoAntibio européen. Des antibiotiques humains de dernier recours y seront interdits chez les animaux, même chez les animaux de compagnie dans le cadre de la cascade (voir LeFil du 21 juin 2018). En outre, dans les productions animales, chaque État membre devra mettre en place un suivi des usages à l'échelle de l'élevage, au plus tard d'ici à 2023 pour les veaux, porcs, volailles, 2026 pour les autres productions animales (ruminants…), ou 2029 pour les autres élevages (chevaux, visons…). Les animaux de compagnie ne seront pas concernés.
En complément de ces deux Fils du 19 et 21 juin, le Fil d'aujourd'hui détaille le nouveau dispositif qui encadrera la prescription en Europe.
Sans surprise, les ordonnances, valables dans toute l'UE, ne pourront être rédigées que par des vétérinaires [art. 110 et 107]. Quelques dérogations sont prévues pour les rares États membres où des prescripteurs pourraient déjà aujourd'hui ne pas être vétérinaire. Pour ne pas tuer ces professionnels du jour au lendemain, un dispositif leur permettra de les conserver. Mais il ne sera pas possible d'étendre ces dérogations à d'autres professionnels comme ont pu le revendiquer un temps quelques rares pharmaciens français. En outre, ces rares ordonnances rédigées par des non-vétérinaires ne seront pas reconnues dans l'UE, mais seulement dans l'État membre concerné.
Si les ordonnances des vétérinaires sont valables dans l'UE, les règles de délivrance restent nationales. La Commission européenne devrait aussi harmoniser le format des ordonnances électroniques.
L'ordonnance ne pourra être rédigée « qu'après un examen clinique ou, hors examen clinique, après toute autre évaluation de la santé du ou des animaux par un vétérinaire ». Cette rédaction est donc compatible avec la prescription hors examen clinique en France.
Deux points importants diffèrent de la rédaction actuelle des prescriptions en France.
L'ordonnance n'est pas obligatoire pour les médicaments administrés par le vétérinaire lui-même. Mais le droit national pourra l'exiger le cas échéant comme c'est le cas aujourd'hui en France (art. 110, point 9).
En productions animales, le registre d'élevage indiquera aussi à l'avenir la maladie visée par le traitement et conservera une preuve de l'acquisition (par un circuit légal !). Sans changement, l'enregistrement du numéro de lot n'est pas exigé ni sur le registre d'élevage, ni sur l'ordonnance remise au propriétaire (art 112).
Les nouveaux critères de prescription ne devraient pas amener à modifier significativement la part des médicaments classés sur prescription [art. 29]. La prescription est obligatoire pour les médicaments suivants :
En outre, des règles nationales — les substances vénéneuses en France — ou des précautions dans la notice pourront aussi conduire à classer « sur ordonnance » un médicament à risque. Des États membres pourront aussi classer des médicaments comme à « administration vétérinaire exclusive ». Alors que cette catégorie n'était pas, jusque-là, explicitement prévue par la réglementation.
La nouvelle cascade dite du « hors AMM »
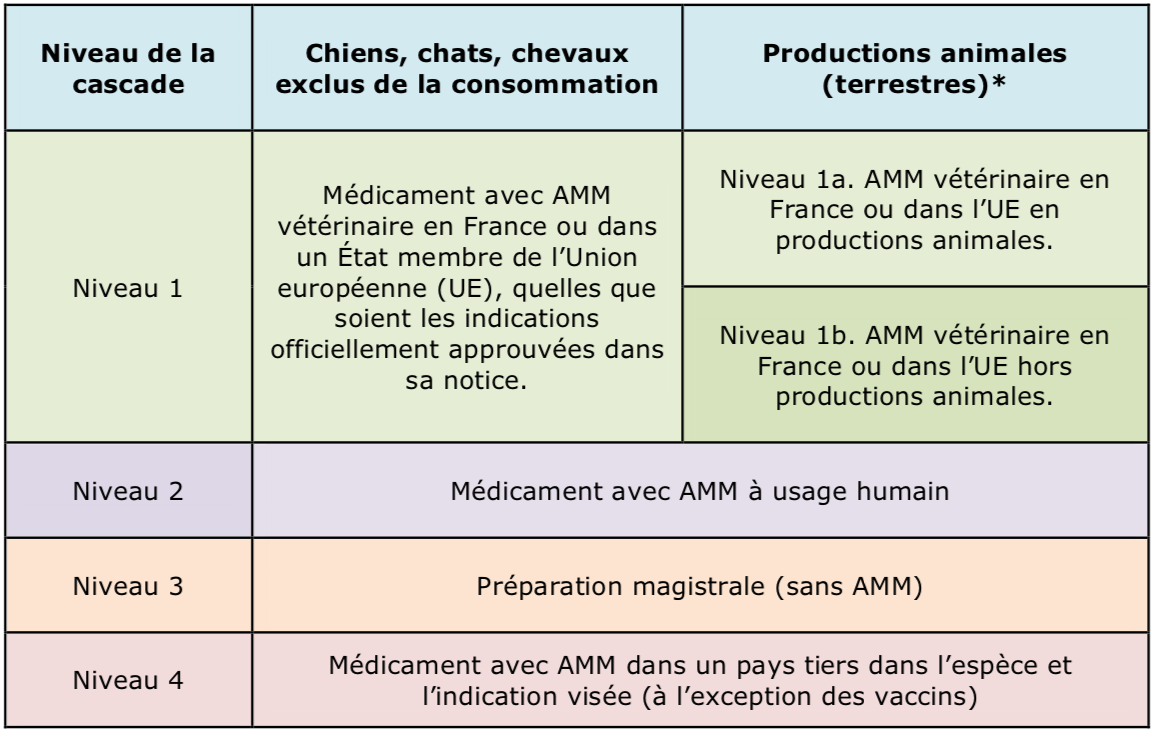
* Une cascade spécifique à l'aquaculture et aux abeilles est prévue.
La nouvelle cascade est indéniablement plus simple la précédente [art. 115 à 118]. Dès lors qu'il n'existe pas en France de médicament disponible approuvé dans l'espèce et l'indication visée, tous les médicaments disposant d'une AMM vétérinaire en France ou dans l'UE pourront être utilisés « dans ou hors AMM » dès le premier niveau de la cascade. L'importation d'un médicament autorisé dans un autre État membre sera donc immédiatement envisageable et facilitée par la mise en place d'une base de données avec tous les médicaments autorisés dans l'UE.
En productions animales, le prérequis des LMR fixées dans au moins une denrée d'une espèce est conservé. Cela conduit à préférer un médicament déjà autorisé en productions animales dans un pays de l'UE (ce qui garantit au prescripteur qu'une LMR a été fixée), avant que de recourir « hors AMM » à un médicament destiné à un animal de compagnie. Dans ce dernier cas, le prescripteur devrait vérifier la fixation préalable des LMR pour les substances actives.
En l'absence d'un médicament avec AMM vétérinaire, le prescripteur privilégiera la qualité pharmaceutique d'un médicament humain avant que de recourir une préparation magistrale sans AMM.
Enfin, dernière nouveauté, la cascade s'ouvre aussi en tout dernier recours à l'importation de médicaments autorisés dans des pays tiers comme les USA, le Canada, l'Australie… bientôt le Royaume-Uni ! Cela ne sera toutefois envisageable que si le médicament importé est bien autorisé dans son pays d'origine dans l'espèce et l'indication visée en Europe. Ce dernier recours ne sera pas possible pour des vaccins.
Les temps d'attente seront aussi plus pragmatiques que ceux actuellement en vigueur.
Chez les équidés, le dispositif des substances essentielles sans LMR n'est pas modifié. Il permet toujours de traiter des chevaux non exclus de la consommation humaine par environ 80 substances sans LMR avec un temps d'attente de six mois.
Comme aujourd'hui en France, le règlement interdira, dans toute l'Europe, de procurer aux vétérinaires et aux ayants droit des cadeaux, des avantages financiers ou en nature sauf dans les trois cas suivants.
Les médicaments ne sont pas distribués dans un but promotionnel, sauf pour des échantillons en petites quantités aux vétérinaires et ayants droit (art. 123).
La publicité pour des médicaments sur prescription est restreinte aux seuls prescripteurs et ayants droit. Ce qui l'interdit donc pour les éleveurs et le grand public (comme dans le droit européen actuel).
Par dérogation à cette interdiction, la publicité auprès des éleveurs pour des vaccins sera permise si un État membre le souhaite et l'encadre dans son droit national [art. 124]. C'est ce que prévoit de faire la France par un décret d'application de la loi Egalim adoptée par les députés le 2 octobre.
23 décembre 2025
 5 min
5 min

22 décembre 2025
 5 min
5 min

19 décembre 2025
 5 min
5 min

18 décembre 2025
 5 min
5 min

17 décembre 2025
 3 min
3 min

16 décembre 2025
 5 min
5 min
