24 octobre 2025
 3 min
3 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


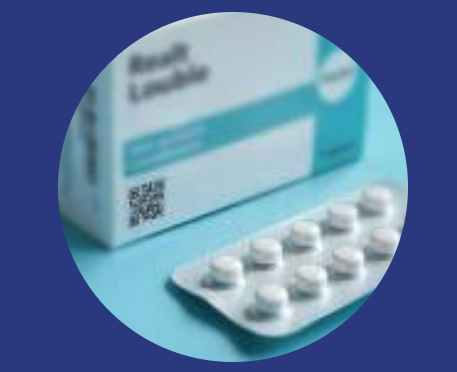
Fini les notices illisibles, écrites en (trop) petits caractères, et qu'on ne parvient jamais à replier convenablement ? Depuis le 1er octobre, l'ANSM, Agence nationale de sécurité du médicament et des produits de santé (à usage humain), a démarré son étude pilote « e-notice ».
Cette dématérialisation des notices, aujourd'hui imprimées, pliées et glissées dans chaque boîte, va être testée sur une période de 2 ans, pour environ 600 médicaments.
La e-notice est la version numérique de la notice d'un médicament. Accessibles en ligne, ces notices dématérialisées présentent plusieurs avantages :
Selon une étude récemment publiée par la Fédération européenne des associations et industries pharmaceutiques (EFPIA), par comparaison à une notice papier, l'impact environnemental d'une notice dématérialisée est réduit de 89 à 98 % sur les différentes catégories d'impact étudiées (écosystèmes, ressources nécessaires, énergie consommée, changement climatique).
Le projet consiste à remplacer les notices « papier » par un QR code renvoyant sur la e-notice du médicament ou produit. Toutes les notices des médicaments humains commercialisés en France sont effectivement hébergées et consultables sur la base de données publique des médicaments (BDPM). Le lien du QR code renvoie ainsi sur son site, directement sur la fiche ad hoc.
La phase pilote qui débute va expérimenter le processus. Elle est prévue sur 2 ans. Son objectif est d'évaluer la facilité d'accès aux e-notices et l'utilité des contenus additionnels, et d'identifier les éventuels freins (techniques ou d'usage). Le comité de suivi du projet associe des représentant des patients, des professionnels de santé et des laboratoires.
Deux enquêtes seront menées (ciblées selon les publics : patients, professionnels, industriels), à mi-parcours (mi-2026) puis à la fin de la phase pilote (octobre 2027). Un questionnaire de satisfaction sera également disponible sur la BDPM. Un suivi spécifique est prévu pour les hôpitaux.
Cette expérimentation concerne près de 600 médicaments, de laboratoires volontaires mais sélectionnés par l'ANSM.
Cette étude pilote se limite aux médicaments à usage humain. Mais selon ses résultats, il apparaît logique que la démarche s'étende ultérieurement au médicament vétérinaire.
Elle s'inscrit dans une évolution portée à l'échelle de l'Europe. En effet, la Commission européenne encourage la transition vers les notices numériques, dans le cadre de la réforme de la législation pharmaceutique. L'initiative française n'est pas isolée, d'autres pays comme la Belgique, l'Espagne ou le Portugal, mènent également des expérimentations voisines.
24 octobre 2025
 3 min
3 min

23 octobre 2025
 6 min
6 min

22 octobre 2025
 4 min
4 min

21 octobre 2025
 4 min
4 min

20 octobre 2025
 3 min
3 min