8 juillet 2025
 6 min
6 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


30 août 2018
Arrêt de la flunixine. La diéthanolamine cancérogène en topique à 40 mg/kg ! L'Europe craint son dérivé nitroso
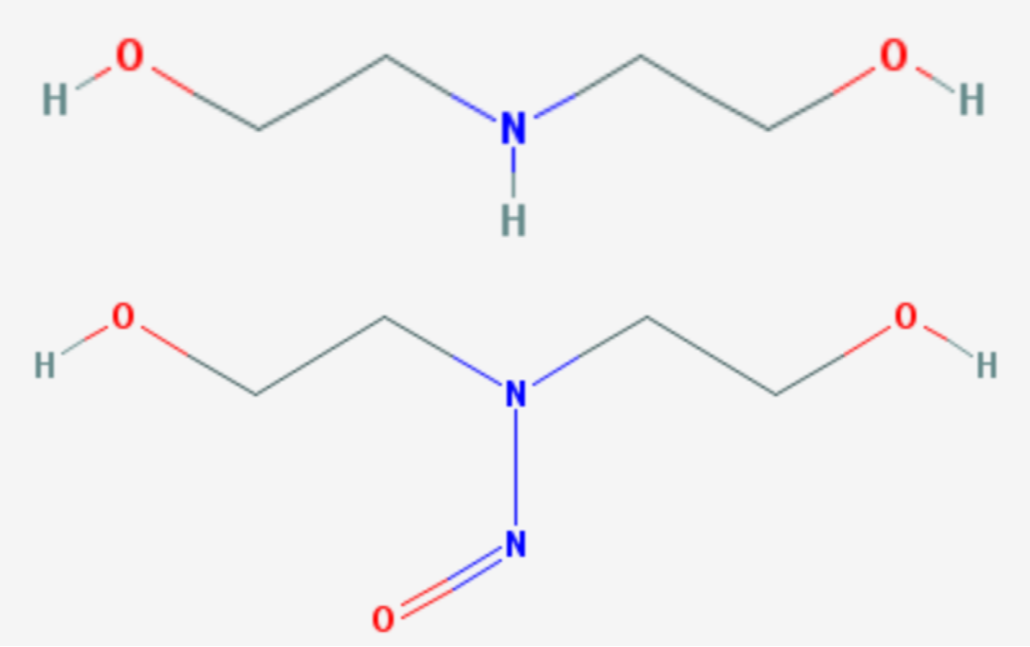

La diéthanolamine (DEA) est cancérogène. Son dérivé nitroso est génotoxique. Cet excipient utilisé comme tensioactif dans les solutions injectables de flunixine ne peut donc pas rester dans la formulation de médicaments vétérinaires destinée aux productions animales, sauf… si un industriel investit quelques millions d'euros pour permettre la fixation d'une hypothétique limite maximale de résidus (LMR).
L'Agence européenne du médicament (EMA) a publié son rapport d'arbitrage défavorable sur le risque cancérogène des résidus de diéthanolamine en apportant quelques preuves sur la toxicité de cet excipient et des supputations sur celle de ses résidus.
Cet arbitrage a conduit au retrait du marché français de toutes les solutions injectables de flunixine (seule), ainsi que deux associations de sulfamides et triméthoprime : Tribrissen° injectable et Duoprim° (MSD) (voir les Fils du 2 et 20 août 2018).
Le rapport de l'Agence européenne répond aux quatre questions qui lui étaient posées par des États membres de l'Union européenne.
Les réponses à ces quatre questions sont synthétisées ci-dessous.
La diéthanolamine est classée depuis 2013 comme cancérogène possible chez l'homme (groupe 2B) par l'IARC, l'agence internationale de recherche sur le cancer. Ce classement repose sur des études de cancérogénicité sur deux ans où la diéthanolamine est appliquée sur la peau des souris à des doses élevées de 40, 80 et 160 mg/kg. À toutes les doses, des tumeurs hépatiques et rénales sont apparues.
Le mécanisme de cancérogénicité n'est pas bien connu. Mais il est « très improbable » que la diéthanolamine soit une substance génotoxique qui altère l'ADN. Il est suggéré un mode d'action épigénétique (c'est-à-dire sans altération de l'ADN) par carence en choline.
Néanmoins, la diéthanolamine pourrait en milieu acide être à l'origine de la formation d'un dérivé nitroso (N-nitroso-diéthanolamine), un composé fortement cancérigène, génotoxique et très réactif avec l'ADN. Ce rapport laisse entendre que les dérivés nitroso pourraient être formés dans l'estomac des consommateurs (en milieu acide) ou par la cuisson (ou d'autres modes de préparation alimentaire).
Si un dossier LMR sur la diéthanolamine est déposé, la formation de ce dérivé nitroso devrait aussi être recherché. Et si elle était confirmée, il deviendrait plus difficile, voire impossible ?, de fixer des LMR acceptables.
Le risque pour le consommateur des dérivés nitroso est généralement jugé comme inacceptable pour le consommateur. Ce sont d'ailleurs les dérivés nitroso du chloramphénicol, des nitrofuranes ou des nitro-imidazolés qui ont conduit à classer ces substances parmi celles interdites d'emploi en productions animales. Car il apparaît impossible de soutenir une LMR même à un niveau très faible pour les dérivés nitroso génotoxiques.
Les données de cancérogénicité par voie topique chez la souris ne permettent pas d'établir une dose sans effet cancérigène (DSE) chez l'animal qui pourrait servir ensuite de base au calcul d'une dose journalière admissible (DJA) chez l'homme puis de LMR (limites maximales de résidus) dans les denrées. Néanmoins, à partir d'une autre étude toxicologique chez la souris, il est proposé une dose sans effet de 10 mg/kg/j.
L'Agence européenne applique un facteur de sécurité très très élevé — 30000 ! —, pour estimer une exposition maximale admissible chez l'homme, soit 0,333 mcg/kg/j (10 mg/kg divisés par 30000) ou 20 mcg/j pour un homme de 60 kg. Habituellement, les facteurs de sécurité sont bien plus faibles : seulement 10 si la substance est inoffensive, 100 dans le cas général voire 1000 pour les composés les plus problématiques, par exemple si une tératogénicité a été démontrée.
Ici, le facteur de sécurité atteint des sommets : 30000 ! La dose maximale admissible pour l'homme serait donc 30000 fois plus faible que la dose sans effet toxique chez l'animal. La fixation des facteurs de sécurité est déterminante. Elle ne repose pas sur des vraies bases scientifiques, mais, à l'inverse sur des principes d'incertitude. Dès 1973, le père de ce concept, le toxicologue français René Thuhaut, rappelait que le « facteur de sécurité est quelque peu arbitraire mais a été largement accepté ». Les scientifiques sont maintenant nombreux à critiquer cette « pseudo-science quelque peu arbitraire » qui date des années 1960. Mais, il faut bien reconnaître que personne n'a proposé mieux que cet arbitraire, qui semble bien protéger la santé du consommateur, vu l'absence de cas humain avéré de toxicité par les résidus de médicaments. En outre, les politiques européennes et même internationales sur les résidus sont bien harmonisés sur ce concept arbitraire mais protecteur de la santé des consommateurs.
Dans les pires des scénarios d'exposition (3 injections de flunixine en un seul jour), les consommateurs pourraient ingérer des doses de d'ordre de 10 à 30 mcg/kg/j. Ces doses sont donc trente à cent fois supérieures à la dose maximale admissible 0,333 mcg/kg calculée avec un facteur de sécurité de 30000. Mais en l'absence d'étude de résidus, il est évidemment impossible de confirmer ou d'infirmer ces chiffres.
Le risque est alors jugé inacceptable pour les consommateurs « en l'absence d'une étude de déplétion des résidus qui pourrait démontrer que l'exposition de 0,333 mg/kg n'est pas dépassée ».
Pour l'Agence européenne des résidus, la fixation d'une LMR est nécessaire pour permettre l'usage de la diéthanolamine comme excipient dans des médicaments destinés aux productions animales. Le dossier de LMR devrait au moins inclure des études de déplétion des résidus dans les espèces cibles (viandes et lait). L'objectif serait alors de démontrer que les niveaux de résidus sont compatibles avec la dose maximale permise pour l'homme (0,333 mcg/kg). La problématique des résidus du point d'injection devrait aussi être prise en compte.
En outre, la question de la formation potentielle de nitrosamines génotoxiques devrait aussi être abordée. Si cette formation de dérivés nitroso était démontrée, la diéthanolamine risquerait alors d'être classée dans les substances interdites d'emploi en productions animales.
Au final, il serait sans doute moins risqué de remplacer la diéthanolamine par un autre tensioactif dans les spécialités concernées. Mais c'est alors le dossier pharmaceutique qu'il conviendrait de refaire, accompagné au moins d'une démonstration de la bioéquivalence entre les formulations anciennes et nouvelles.
8 juillet 2025
 6 min
6 min

7 juillet 2025
 4 min
4 min

4 juillet 2025
 3 min
3 min
3 juillet 2025
 5 min
5 min

2 juillet 2025
 4 min
4 min

1er juillet 2025
 4 min
4 min
