20 juin 2025
 5 min
5 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


2 octobre 2017
Les aminosides critiques ou semi-critiques selon l'Agence européenne. Les péni-strepto sont remises en cause
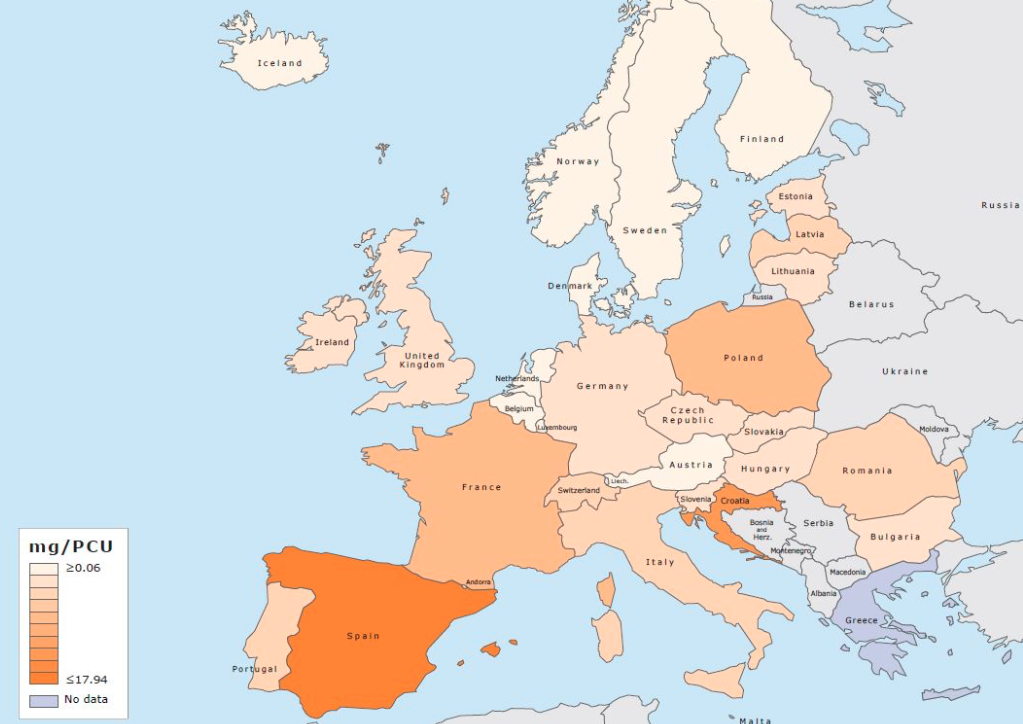

Un projet de note de réflexion de l'Agence européenne du médicament (EMA) sur les aminosides recommande de les classer dans la catégorie 2 des antibiotiques dits critiques. En Europe, cette catégorie 2 des molécules dont l'usage vétérinaire est « à risque élevé pour la santé humaine » comprend déjà les fluoroquinolones, les céphalosporines de dernières générations (C3G/C4G), la colistine et, dans l'attente d'une évaluation plus approfondie, l'amoxicilline et l'ampicilline (pénicillines A).
Cette classification européenne n'a pas, pour le moment, de caractère contraignant sur le droit national des États membres. Ainsi, en France, seules les fluoroquinolones et les C3G/C4G sont classés en antibiotiques critiques avec des restrictions sur leurs usages. La colistine ne devrait pas y être inscrite, même si l'objectif de réduction de 50 % de la colistine en cinq ans est inscrit au plan EcoAntibio2.
Ce projet de classification des aminosides en antibiotiques « semi-critiques », à un niveau de risque inférieur aux C3G/C4G et aux fluoroquinolones, est mis en consultation publique jusqu'à fin octobre pour une adoption en 2018. Il serait en effet contre-productif que le classement des aminosides dans les antibiotiques critiques provoque un accroissement de molécules encore plus critiques.
L'Agence européenne du médicament ne manque pas d'arguments pour justifier ce classement. En Europe, les aminosides vétérinaires sont autant utilisés par voie orale (44 %) que par voie injectable (43 %). En France, la popularité des associations « peni-strepto » ou « péni-néo » fait que les formes injectables représentent 60 % des usages vétérinaires.
Mais le risque est évidemment plus élevé par voie orale, surtout qu'il s'agit principalement de traitements collectifs par l'eau de boisson ou les aliments de jeunes animaux. L'absence de résorption intestinale des aminosides augmente aussi la pression de sélection des résistances sur la flore intestinale.
Répartition des usages et des tonnages des aminosides vétérinaires
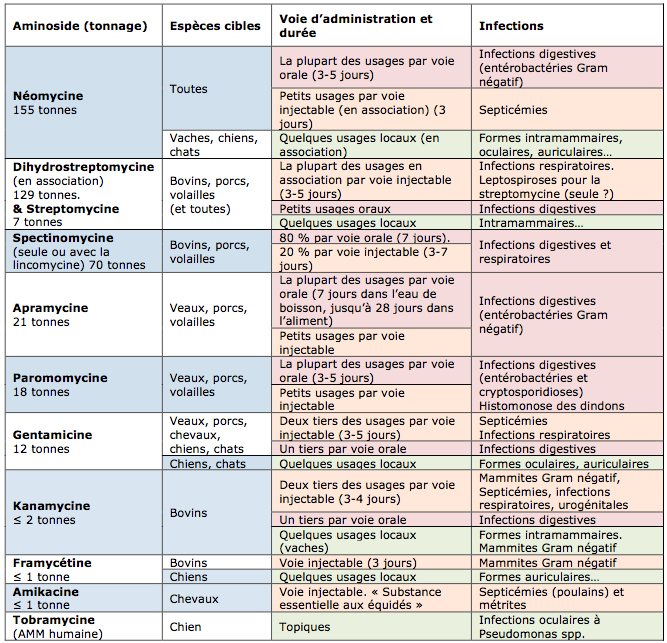
Dans ce tableau, les usages par voie orale à « risque plus élevé » sont sur fond rouge (44 % des usages). Ceux par voie injectable (43 %) sont sur fond orange. Les usages locaux, auriculaires, oculaires ou intramammaires, sont à « risque faible » et sur fond vert.
Les résistances aux aminosides sont d'autant plus problématiques qu'elles sont, le plus souvent, portées par des supports génétiques « mobiles », notamment des plasmides, des transposons ou des intégrons. Ces supports peuvent plus facilement être transférés des animaux à l'homme. En outre, les aminosides cosélectionnent d'autres résistances portées par les mêmes plasmides, notamment les bêtalactamases à spectre étendu (BLSE) qui confèrent les résistances aux C3G/C4G des entérobactéries, la principale cible des aminosides par voie orale.
Le risque vis-à-vis des résistances est moins élevé avec les formes injectables. Il est même jugé « faible » avec les formes locales : intramammaires, auriculaires, oculaires… Mais les fréquentes associations des aminosides avec les bêtalactamines (ou d'autres classes) posent d'autres problèmes. Historiquement, elles sont justifiées par une synergie. Les bêtalactamines agissent sur les parois des germes. Elles ouvrent ainsi la porte aux aminosides dont l'action est intracellulaire, mais dont la structure chimique ne leur permet pas facilement de traverser les membranes et de pénétrer dans le milieu intracellulaire. En pratique, ces associations sont surtout prescrites pour élargir le spectre des aminosides, centrée sur les Gram négatif anaérobies, vers les streptocoques, les entérocoques et les anaérobies.
En élargissant le spectre, les associations élargissent la pression de sélection des résistances à davantage de germes. Et elles accroissent donc le risque de cosélection des résistances, notamment celles aux bêtalactamines, les plus problématiques pour la médecine humaine.
Ces associations avec les bêtalactamines qui ont fait la popularité des « peni-strepto » (ou des « péni-néo ») sont donc remises en cause. Leur justification devra probablement être réévaluée à moyen terne, sans doute dans le cadre d'arbitrages européens.
Autre point difficile : les taux élevés de résistances à la streptomycine peuvent aussi conduire à remettre en cause ces formulations péni-strepto et toutes celles à base de cet aminoside. Car l'Agence européenne du médicament s'interroge sur le maintien d'un antibiotique devenu inefficace tant les résistances sont fréquentes (> 30 ou 50 %). Pour l'EMA, de tels niveaux de résistances ne permettent plus de justifier d'un usage empirique en première intention de cet aminoside sans antibiogramme préalable. Cette conclusion est étendue à la spectinomycine qui partage le mécanisme de résistance le plus fréquent à la streptomycine. Pour l'Agence européenne, de tels niveaux de résistance peuvent donc aboutir, à terme, à remettre en cause les AMM des formulations à base de (dihydro)streptomycine.
Les résistances aux autres aminosides, principalement à la néomycine et à la gentamicine, sont heureusement beaucoup plus faibles. Aujourd'hui, les résistances à la gentamicine chez les animaux ne sont pas considérées comme inquiétantes pour la santé animale ni, heureusement, pour la santé humaine.
En santé humaine, les usages sont beaucoup plus rares qu'en médecine vétérinaire : 4,7 tonnes soit 0,2 mg/kg chez l'homme (versus 291 tonnes et 5,2 mg/kg chez les animaux). La plupart des usages sont réalisés par voie injectable dans les hôpitaux et concernent la gentamicine, la tobramycine et l'amikacine. Malgré leur néphrotoxicité, ils représentent la seconde classe d'antibiotiques injectables la plus utilisée (25,3 %), mais loin derrière les céphalosporines (44,6 %). La gentamicine est même le premier antibiotique injectable utilisé en médecine humaine en Europe (18,5 %), juste au-dessus de céphalosporines comme la ceftriaxone (17,8 %) ou la céfazoline (13,2 %).
Les indications des aminosides sont cruciales pour la médecine humaine :
Pour éviter que les aminosides humains (sans AMM vétérinaire), tels que la tobramycine et l'amikacine, ne soient prescrits chez les animaux, fussent-ils de compagnie, l'Agence européenne propose de les classer dans la catégorie 3 des antibiotiques à proscrire chez les animaux sauf « absolue nécessité ». Dans l'UE, l'amikacine est toutefois classée comme une substance essentielle aux équidés en « alternative à la gentamicine » dans le « traitement des arthrites septiques ».
Les vétérinaires pourraient aussi tirer profit des enseignements de la médecine humaine sur la posologie de la gentamicine, de l'amikacine et de la tobramycine. Ces antibiotiques sont en effet bactéricides doses dépendants : il conviendrait de privilégier les doses plutôt que la durée du traitement. Réalisée en médecine humaine pour la seule voie injectable, l'analyse PK/PD (pharmacocinétique-pharmacodynamie) conclut qu'il convient donc d'espacer toutes les 24 heures des injections à des doses élevées (au lieu de répéter ces injections à plus petites doses toutes les 8 à 12 heures). L'objectif est que le pic plasmatique soit 10 à 12 fois supérieur à la CMI du germe Gram négatif en cause (ratio Cmax/CMI ≥ 10-12). De tels schémas sont plus efficaces et présentent une moindre toxicité rénale en médecine humaine.
Ces conclusions sont souvent promues pour la médecine vétérinaire. Mais, en l'absence d'études spécifiques chez les animaux, les dossiers d'AMM et les RCP (résumés des caractéristiques du produit) qui en découlent, sont restés sur des injections répétées toutes les 8 ou 12 heures.
Enfin, comme pour la colistine, une durée de traitement supérieure à 7 jours n'est pas justifiée pour les aminosides dose-dépendants. Des durées de plus de 7 jours devraient être contre-indiquées à l'avenir.
L'Agence européenne recommande donc à moyen terme une révision des AMM et les RCP des aminosides à travers des arbitrages européens dont les conclusions sont applicables à toute l'UE. Dans ce cadre, une analyse PK/PD permettrait peut-être de modifier les schémas posologiques des aminosides injectables, surtout pour la gentamicine.
Ce document regrette aussi l'absence de breakpoint clinique en médecine vétérinaire dans l'interprétation des antibiogrammes. En effet, leur interprétation est le plus souvent basée sur des seuils épidémiologiques, pas toujours prédictifs d'une efficacité clinique. En France, les seuils des antibiogrammes vétérinaires sont en effet basés sur des seuils (ou « cut-off ») épidémiologiques sans prise en compte des données cliniques.
« Les antibiogrammes peuvent [ainsi] conclure que les aminosides sont actifs in vitro vis-à-vis des entérocoques, alors qu'ils ne sont pas efficaces en clinique. Les entérocoques ne devraient pas être mentionnés comme sensibles aux aminosides dans les antibiogrammes. » Les entérocoques et les streptocoques sont d'ailleurs peu sensibles aux aminosides, mais ils peuvent sélectionner des résistances et les diffuser largement ensuite. Les aminosides ne devraient donc être prescrits en clinique contre ces germes estime l'Agence européenne du médicament.
La classification vétérinaire proposée depuis 2013 par l'Agence européenne du médicament ne vise que les antibiotiques classés comme critiques pour la médecine humaine par l'OMS (organisation mondiale de la santé).
Intentionnellement, l'Agence n'utilise pas le terme d'antibiotique « critique » pour les usages vétérinaires. Mais elle classe ces antibiotiques en trois catégories.
Classification européenne des antibiotiques vétérinaires en catégories 1, 2 ou 3.
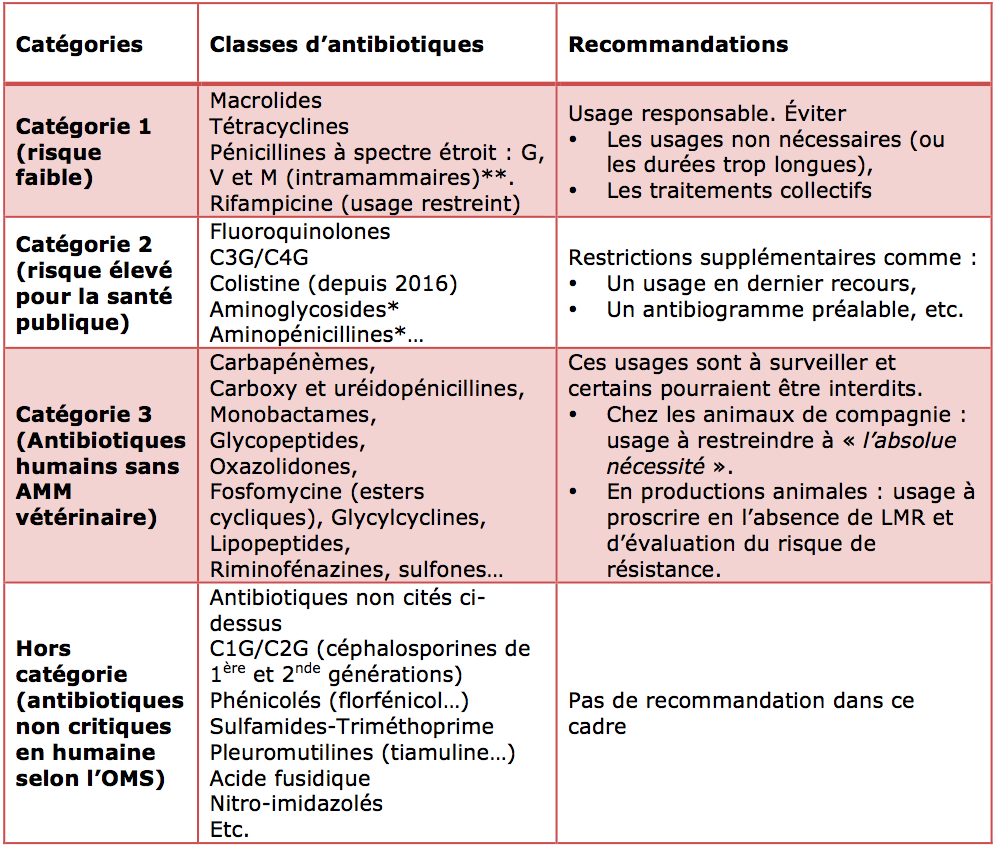
* Catégorisation provisoire.
Cette classification a été adoptée en 2013 sous réserve d'une réévaluation du risque pour les aminosides (en cours avec ce document) et les pénicillines A comme l'amoxicilline (actives sur les entérobactéries).
En 2016, la colistine, jusque-là en catégorie 1, a été classée en catégorie 2.
20 juin 2025
 5 min
5 min

19 juin 2025
 4 min
4 min

18 juin 2025
 6 min
6 min

17 juin 2025
 3 min
3 min
16 juin 2025
 4 min
4 min

13 juin 2025
 4 min
4 min
