7 janvier 2026
 5 min
5 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


3 mars 2017
Des membranes à base de miel confirmées bactéricides vis-à-vis de plusieurs pathogènes canins, et utiles en prévention des adhérences (chez le rat)

Le recours au miel de manuka pour son activité antiseptique en application topique en médecine humaine est bien connu. Une équipe de l'université vétérinaire de Turin (Italie) vient de publier les résultats d'essais in vitro du recours à des membranes fabriquées à partir de miel manuka ou de miel de miellat sur des bactéries vétérinaires : Staphylococcus pseudintermedius, E. coli, Proteus mirabilis et Pseudomonas aeruginosa. Tous ces isolats sont multirésistants et issues d'infections canines.
Ces cliniciens souhaitaient évaluer s'ils pouvaient, en la matière, consommer local. Ils ont en effet comparé pour cette action bactéricide un miel de miellat produit au Piémont au miel “de référence”, à activité bactéricide largement prouvée et provenant de Nouvelle-Zélande ou d'Australie, le miel de manuka. Le manuka est un arbuste endémique, Lectospermum scoparium. Avec une même technique à partir de pectine, les auteurs ont fabriqué des membranes contenant soit du miel de manuka, soit du miel de miellat piémontais.
Des carrés de ces membranes ont été placés à l'intérieur d'une boîte de Pétri, et l'inoculum de chaque pathogène (400 µl d'environ 106 UFC par échantillon) était placé à leur surface, puis recouvert d'un carré (40 x 40 mm) de plastique stérile. L'incubation à 35° C sous 90 % d'humidité relative a été réalisée sur 48 h, mais les comptages bactériens ont été réalisés à l'ensemencement, puis à 1, 3, 6 et 24 h. Ce protocole est conforme à la norme ISO de mesure de l'activité antibactérienne des surfaces plastiques. Pour les deux types de miel, la croissance de tous les isolats est totalement inhibée à 24 h d'incubation. En revanche, dans la culture témoin (même inoculum sur une gélose classique), après 24 h, les germes atteignaient une charge de 1012 UFC/échantillon.
Sur la période 0-24h, les cinétiques sont légèrement différentes selon les miels et les pathogènes :
Ces résultats « suggèrent que les membranes [préparées avec chaque miel] sont capables de promouvoir efficacement le processus de guérison de blessures et pourraient être utilisés dans différentes applications de la médecine et de la chirurgie vétérinaires ». La conclusion n'est pas innocente car la même semaine, une autre publication du même groupe rapporte l'utilisation d'un hydrogel à base de pectine et de miel, utilisé cette fois en chirurgie, pour « tenter de réduire les adhérences intrapéritonéales ». Cette fois, le travail est réalisé in vivo, chez le rat.
Une laparotomie par la ligne blanche a été réalisée sur 48 rats, sous anesthésie générale. Pour simuler une inflammation péritonéale, l'apex du côlon a été externalisé, et « frotté avec une compresse stérile » ; la face interne de la paroi abdominale a été « abrasée avec une lame de scalpel n° 21 ». Ces abrasions étaient réalisées « de manière à visualiser des points hémorragiques, sans perforation ». Avant de remettre le côlon dans sa position anatomique, l'animal était tiré au sort pour mise en place ou non du carré 'pectine+miel' entre la lésion et le péritoine. Quinze jours après la chirurgie, les rats ont été euthanasiés, disséqués et les adhérences ont été notées de 0 (absence) à 3 (adhérences denses nécessitant le scalpel pour les disséquer). Une histologie a été réalisée sur les parois coliques et abdominales initialement abrasées. Là encore, une notation a été réalisée (inflammation, activité fibroblastique et néovascularisation, notées de 0 à 3). « Aucune infection de site chirurgical ni abcès n'ont été observés sur aucun rat ».
Sur le critère de présence/absence d'adhérences, l'avantage est au groupe de rats chez lesquels le carré a été mis en place (fréquence réduite d'un facteur 3, p=0,0012, voir le tableau ci-dessous). En revanche, il n'y avait pas de différence pour les adhérences entre l'apex du côlon et la ligne blanche (8 dans le groupe témoin, 5 dans le groupe traité). La distribution des notes d'adhésion était très différente entre les deux groupes (p=0,0003), à l'avantage du groupe traité. Le même niveau de signification statistique est observé pour la notation histologique. Ainsi, les auteurs concluent que la membrane placée « présente un effet anti-adhérence localisé », dans le modèle animal retenu. Ils soulignent aussi que le dosage du miel est critique : placé en excès, lors d'une étude préliminaire, les animaux du groupe sont morts d'ascite, probablement par effet osmotique.
Synthèse des résultats de la présence et de l'importance des adhérences intra-abdominales dans le modèle chirurgical réalisé chez le rat (LeFil, d'après Giusto et coll., 2017).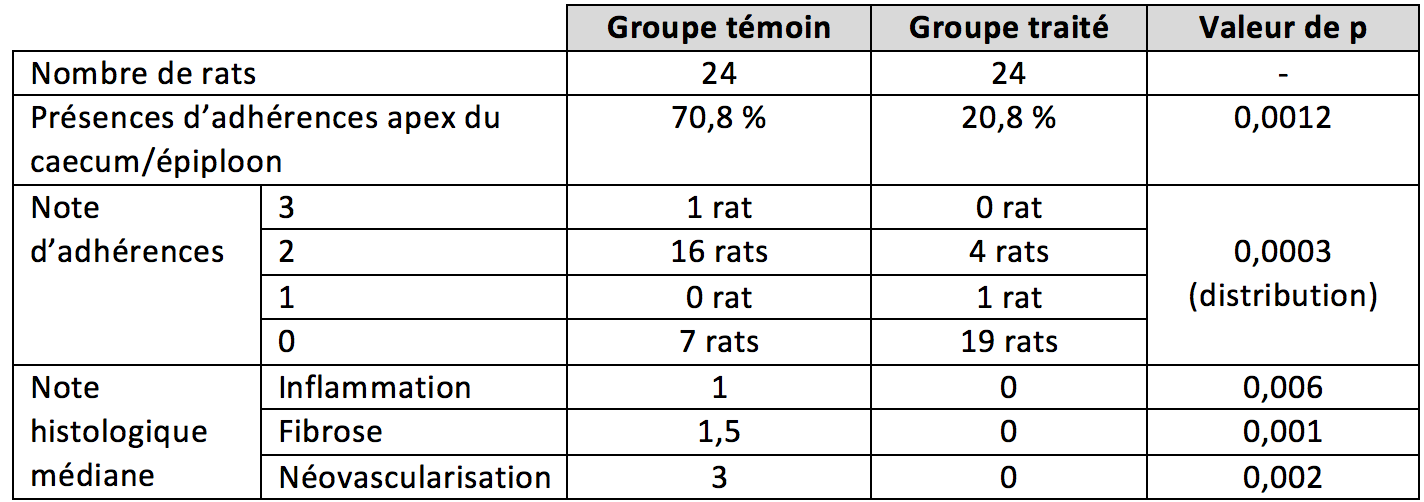
En médecine humaine, de nombreuses études ont déjà démontré l'efficacité du miel de manuka utilisé en topique contre des infections bactériennes. Une revue de synthèse a été publiée récemment par la Cochrane Library, site de référence pour la médecine factuelle. Elle ne mentionne pas d'usage en prévention des adhérences. Selon l'indication topique, le niveau de preuve est plus ou moins avéré :
Dans les deux études italiennes, la première étape de la fabrication des membranes est la même : mélange d'abord à volumes équivalents du miel (liquide) et de l'eau déminéralisée stérile. Puis un demi-volume de poudre de pectine est ajouté, qui requiert une agitation constante. La pectine utilisée ici est biodégradable et biocompatible. L'agitation est coupée lorsque l'aspect de la solution est homogène.
Les carrés sont ensuite empaquetés sous vide et irradiés (stérilisation par rayons gamma, à 25 kGy). Les auteurs ne précisent pas l'origine du miel utilisé dans la seconde étude.
7 janvier 2026
 5 min
5 min

6 janvier 2026
 4 min
4 min

5 janvier 2026
 4 min
4 min

23 décembre 2025
 5 min
5 min

22 décembre 2025
 5 min
5 min

19 décembre 2025
 5 min
5 min
