8 juillet 2025
 6 min
6 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


29 août 2018
Vers un transplant sous-cutané de cellules pancréatiques, pour une rémission temporaire du diabète de type 1 chez le chien ?
Une injection tous les (quelques) mois pour traiter le diabète de type 1, à la place des injections quotidiennes d'insuline… C'est la perspective que dessine le service de communication de l'université de Purdue (USA), à partir de résultats publiés cet été sur… souris. Le chien est annoncé comme le prochain modèle, dans un communiqué de presse un peu vendeur. Pour autant, l'approche, par son originalité et la qualité des résultats obtenus, pourrait se révéler payante… Au moins chez le chien, même si l'objectif des chercheurs est évidemment la prise en charge du diabète de type I chez l'Homme.
Le dispositif n'est pas nouveau dans son principe : (micro)-encapsuler des îlots de cellules ß du pancréas dans un biomatériau qui les protège du système immunitaire de l'hôte, tout en permettant la vascularisation du greffon. La nature du biomatériau utilisé par les chercheurs de l'université de Purdue est originale car il s'agit d'un des composants de la matrice extracellulaire dans laquelle sont naturellement enchâssés les îlots ß du pancréas : le collagène fibrillaire (de type I). Les travaux de développement in vitro de ces tissus avaient déjà montré que les motifs portés par les fibres de collagène de type I « favorisent la survie des cellules des îlots, leur différentiation et leur fonction » de sécrétion. Et le fait d'être encapsulé dans une matrice tridimensionnelle (par opposition aux deux dimensions de la culture de tissus) « maintient la polarité et l'organisation des cellules, prolongeant leur fonctionnement ».
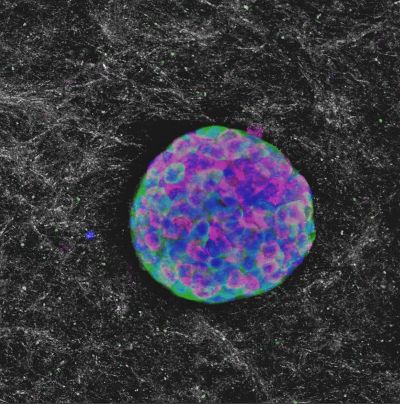
Là où d'autres équipes ont tenté de mettre au point des matrices à base de monomères de collagène, celle de Purdue s'est orientée vers des assemblages (oligomères), « qui conservent des liens intermoléculaires, permettant aux fibrilles de se réassembler rapidement en cas de désagrégation [par exemple sous l'action de protéases des cellules] et fournissant un échafaudage fibrillaire » dans lequel les cellules peuvent s'insérer. Ces matrices ont aussi une meilleure résistance mécanique. Après avoir construit des matrices de différentes densités en oligomères, les auteurs ont « micro-encapsulé » dans celles présentant une densité optimale des cellules d'îlots ß du pancréas prélevées sur des souris de laboratoire. Un premier volet a permis aux auteurs de déterminer qu'il faut 3 g de cellules d'îlots ß du pancréas par microcapsule pour fournir une densité cellulaire équivalente à celle d'îlots fonctionnels, au terme de 2 semaines de culture dans cette matrice (voir l'image principale).
Ensuite, la préparation a été transplantée sous la peau de souris dont le diabète avait été induit chimiquement. En bref, le collagène se solidifie une fois dans le compartiment sous-cutané, et le transplant sécrète l'insuline dès le lendemain de l'injection. Une néovascularisation locale s'établit, qui permet aux cellules transplantées de faire leur travail sans avoir à rejoindre le foie ni le pancréas. Le principe est donc « minimalement invasif », et le diabète est endigué. La publication détaille les résultats des essais en modèle souris. Ils observent une activité physiologique du transplant pendant :
Histologie (hémalun-éosine) des îlots encapsulés dans l'espace sous-cutané sous le muscle (panniculus carnosus). Cliché : université de Purdue, USA, 2018.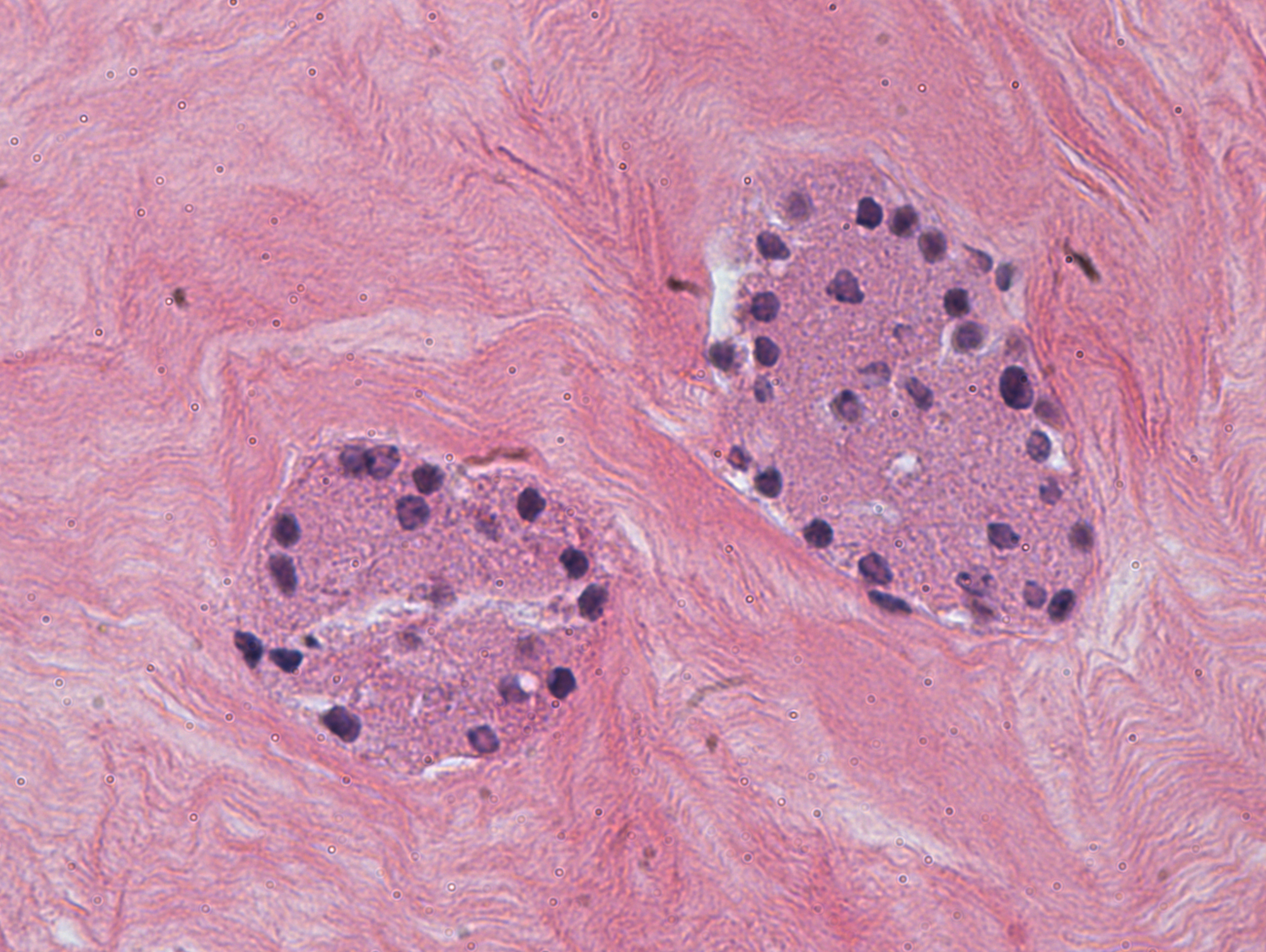
Dans tous ces cas, la courbe de glycémie était revenue à la normale chez tous les animaux 24 h après la transplantation. Jusqu'à présent, les transplantations de cellules de l'îlot ß du pancréas sont réalisées chez l'Homme à titre exceptionnel par injection dans la veine porte hépatique, technique trop invasive pour un traitement ambulatoire, et qui expose les cellules transplantées aux macrophages résidents, imposant de disposer de multiples donneurs et d'immunodéprimer le receveur. Dans la stratégie développée par cette équipe, la localisation sous-cutanée permet également d'intervenir pour retirer le transplant en cas de rejet. Le communiqué de l'université de Purdue précise que cette « nouvelle thérapeutique est en essai clinique chez le chien », ce qui est un peu précipité. Les chercheurs confirment qu'un tel essai est à l'étude, avec des îlot ß du pancréas d'origine porcine, mais que l'essai « reste encore à lancer ».
8 juillet 2025
 6 min
6 min

7 juillet 2025
 4 min
4 min

4 juillet 2025
 3 min
3 min
3 juillet 2025
 5 min
5 min

2 juillet 2025
 4 min
4 min

1er juillet 2025
 4 min
4 min
