2 mai 2024
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


28 juillet 2016
Ruptures. Un décret oblige les industriels à pallier les pénuries des médicaments… humains
En santé animale, comme en santé humaine, les pénuries sont de plus en plus fréquentes. La faute à qui ? Sans doute en grande partie à la mondialisation, aux fusions-acquisitions, à la délocalisation, à l'éloignement des sites de productions, aux Chinois (qui synthétisent plus de 50 % des matières premières) et aussi, parfois, à l'augmentation des ventes.
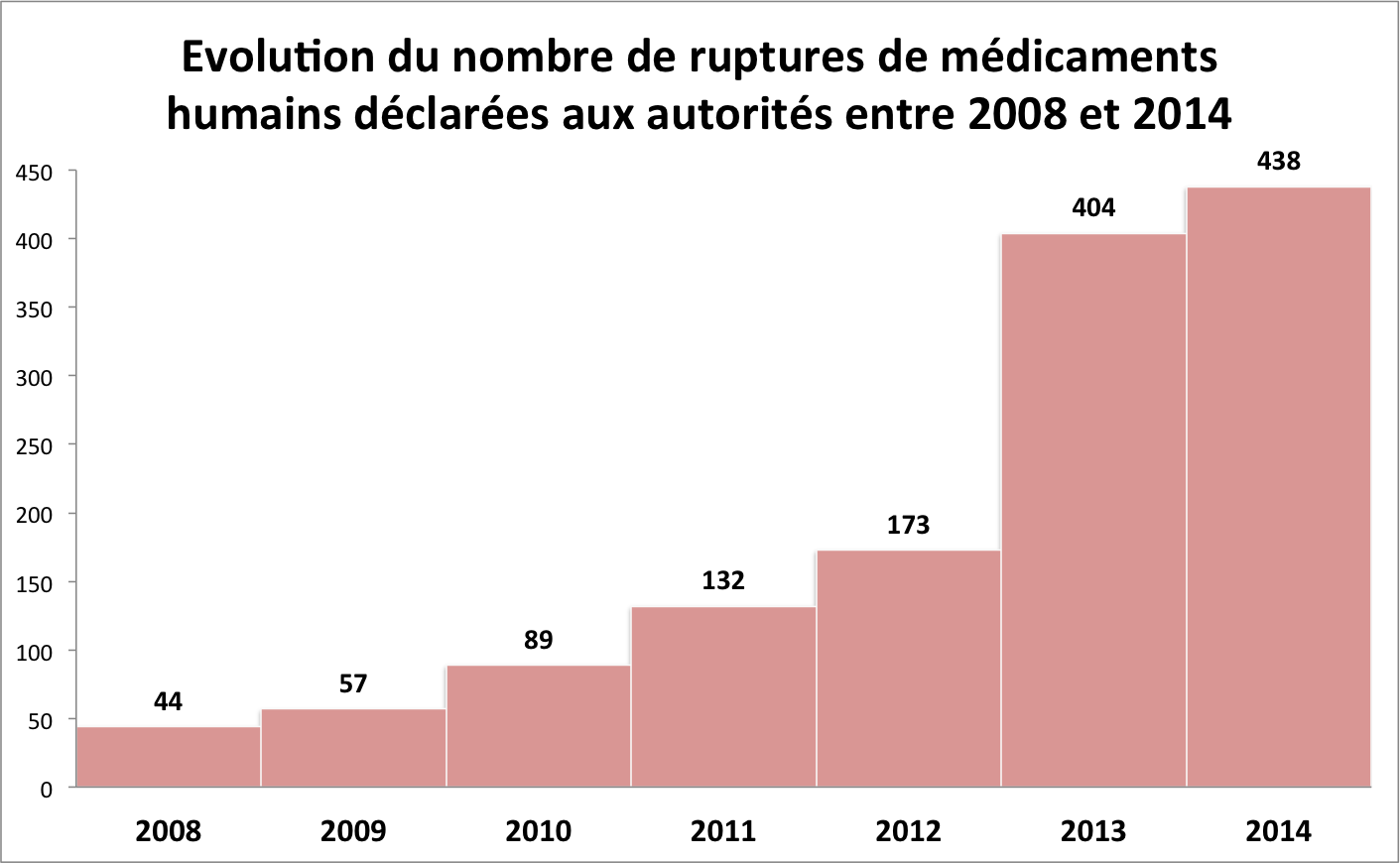
En six ans, le nombre de ruptures de médicaments dans les centrales vétérinaires a été multiplié par 1,8. Dans le même laps de temps, les ruptures de médicaments humains ont été multipliées par dix !
Les pénuries sont donc une préoccupation à la fois de santé humaine et animale. Elles pourraient, elles aussi, entrer dans le concept « one health ». Le phénomène semble mondial — + 40 % de ruptures en un an aux États-Unis —. Il est crucial, car il touche de plus en plus de vaccins ou de médicaments dits « essentiels ».
Et les mêmes causes semblent à l'origine des mêmes pénuries dans les deux médecines. Les taux de ruptures sont d'ailleurs assez proches : entre 1,5 et 2 % des médicaments vétérinaires référencés par les centrales, 1,9 % des médicaments humains en juin 2016 selon l'Ordre des pharmaciens qui suit ces pénuries au jour le jour.
Selon les estimations d'une centrale vétérinaire, les ruptures dues au grossiste qui se trouverait incapable de livrer un médicament disponible auprès du laboratoire sont très minoritaires, environ le quart du nombre total des ruptures. Il peut parfois s'agir des délais logistiques nécessaires au transport et à la vérification d'une livraison tardive.
Pour les médicaments humains, le code de la santé publique distingue bien les défauts d'approvisionnement, liés à des retards dans la chaîne de distribution, des ruptures de stock imputables à l'incapacité de production des industriels.
Le pharmacien peut déclarer une rupture d'approvisionnement lorsqu'il est dans l'impossibilité de délivrer un médicament à un patient dans un délai maximal de 72 heures, alors qu'il s'est adressé à au moins deux grossistes.
Source : Les entreprises du médicament (Leem). Enquête sur un an entre septembre 2012 et octobre 2013.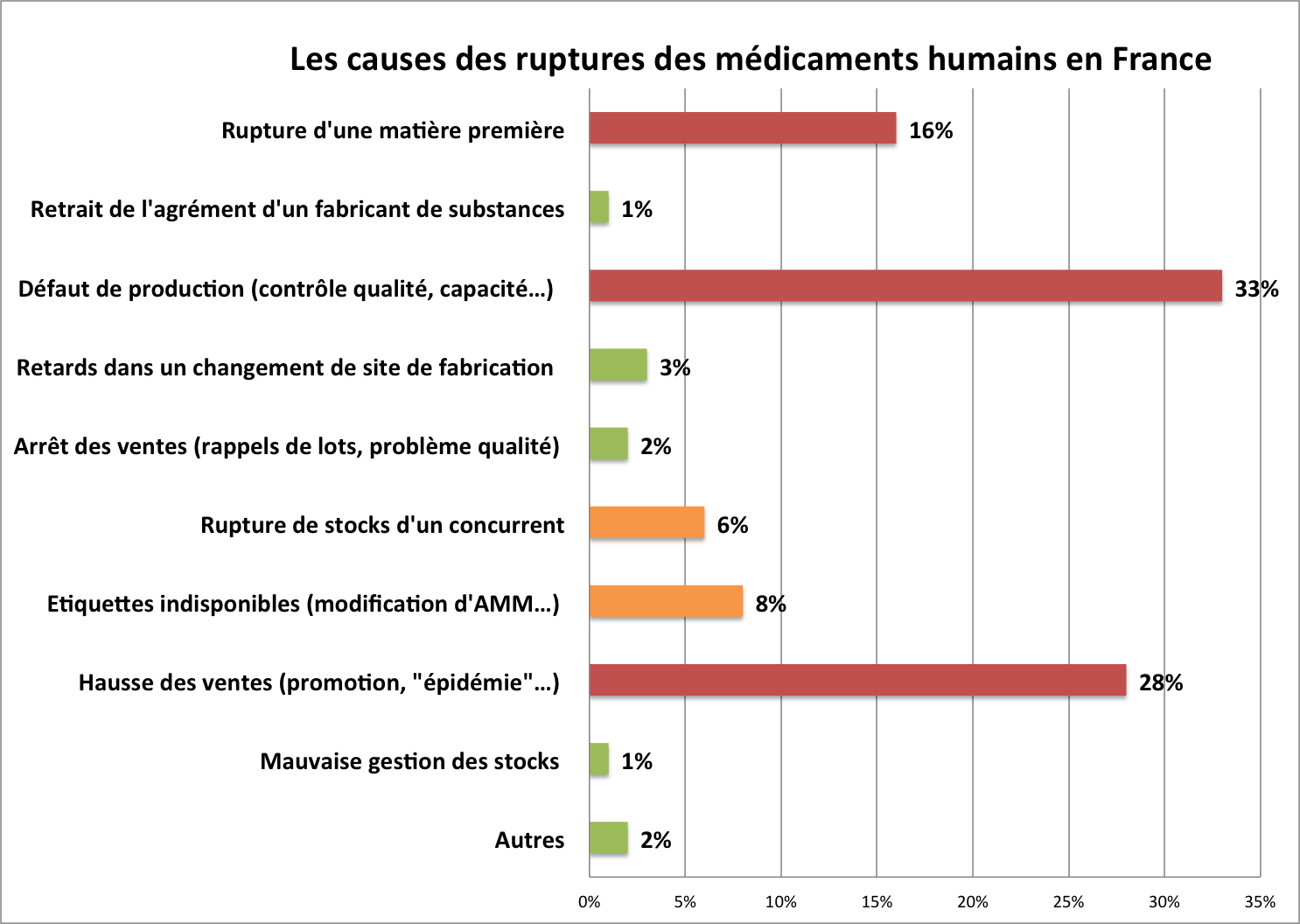
De nombreuses causes de ruptures ont été identifiées par les industriels eux-mêmes tout au long de la chaîne de fabrication. Mais seulement trois d'entre elles seraient responsables des trois quarts des ruptures : les défaillances des usines pharmaceutiques (33 %) ou des producteurs de matières premières (16 %), et une augmentation imprévue des ventes (28 %).
L'incapacité d'un site de production d'un fabricant à produire en quantités suffisantes est donc la première cause de ruptures. Les industriels l'expliquent par la spécialisation, la mondialisation, la délocalisation et ainsi la réduction du nombre de sites de fabrication des médicaments. Les multiples fusions-acquisitions ont conduit à ce que les usines soient de moins en moins nombreuses. Les lignes de production sont de plus en plus spécialisées, délocalisées pour couvrir un marché de plus en plus mondialisé. Ces usines sont donc moins flexibles et réactives que par le passé si les prévisions des ventes d'un pays comme la France se sont avérées insuffisantes. Surtout si le lointain marché français n'est plus considéré comme prioritaire. En outre, la défaillance d'un site ne peut plus être facilement compensée par un transfert de production sur un autre site. L'éloignement des sites de production hors de l'Union européenne nécessite aussi des contrôles à l'importation qui retardent la libération des lots importés, voire l'interdisent en cas de non-conformité.
En amont de la fabrication des médicaments, les producteurs de matières premières, principes actifs ou excipients, sont souvent accusés d'être les premiers responsables des ruptures. D'autant qu'ils sont presque tous délocalisés. Dans les années 80, 80 % des matières premières étaient produites en Europe. Trente ans plus tard, la proportion s'est inversée. 80 % des matières premières sont importées de pays aussi lointains qu'incertains. Aujourd'hui, 53 % des substances actives pharmaceutiques sont produites en Chine et 22 % en Inde. De nombreuses substances actives ne sont d'ailleurs plus produites qu'en Chine ou en Inde.
Ainsi la fermeture d'une usine en Chine a provoqué une rupture de longue durée sur la pénicilline G. En outre, ces pays d'Asie sont globalement plus à risque que ceux de l'Union européenne ou que les États-Unis. Les approvisionnements y sont donc plus hasardeux. Les risques climatiques, environnementaux, voire politiques, ne sont pas non plus à exclure.
En cas de défaillance d'un fournisseur, le laboratoire pharmaceutique n'a pas d'alternative facile et rapide. Il ne peut pas rapidement transférer ses achats de matières premières sur un autre producteur pour alimenter ses usines. Car il conviendrait alors de demander une modification du dossier d'AMM. Et cela nécessiterait un délai d'environ deux ans avant de valider la matière première d'un nouveau fournisseur. Parfois, sur les médicaments les plus sensibles, les laboratoires peuvent anticiper une telle situation en qualifiant d'emblée deux fournisseurs pour une même matière première. Mais, même dans ce cas, quand le premier est en rupture, le second le devient rapidement par ricochet.
Les contrôles pharmaceutiques exigent le « zéro défaut » alors que, parallèlement, les exigences réglementaires sont, globalement, de plus en plus élevées en Europe sur la qualité des médicaments. Mais ce « zéro défaut » est parfois plus préjudiciable qu'une certaine tolérance, si elle peut permettre d'éviter des ruptures en médicaments essentiels.
La multiplication des rappels de lots chez les grossistes, pour des défauts qualité mineurs, serait à l'origine de 2 % des ruptures en pharmacie humaine.
Les usines ne sont pas les seuls responsables des ruptures. Une mauvaise anticipation des ventes ou des besoins est aussi responsable de près de 30 % des ruptures. Ainsi, une promotion efficace, un lancement réussi, la rupture d'un produit concurrent… peuvent rapidement faire doubler, voire tripler, les ventes…
Par exemple, à l'été 2014, l'anticipation de la publication de la loi d'avenir a fait bondir les achats d'antibiotiques dans des volumes imprévisibles… Mais, à l'inverse, depuis 2015, les baisses importantes des prix catalogue des antibiotiques n'incitent évidemment pas à les stocker pour éviter la dépréciation brutale des stocks. Cela accroît évidemment le risque de ruptures pour ces médicaments pourtant vitaux.
Pour les laboratoires pharmaceutiques, leur propre gestion interne des stocks ne leur apparaît pas comme une source fréquente de ruptures, ou seulement dans 1 % des cas. Pour eux, ce sont les grossistes (humains) qui appliquent cette politique de gestion à flux tendus, même s'ils ont l'obligation légale de disposer d'un stock minimal de 15 jours.
Les centrales vétérinaires ont d'ailleurs la même obligation de disposer d'au moins deux semaines de stocks pour couvrir les besoins habituels des praticiens. En pratique, ce stock minimal de médicaments détenus en centrales serait largement dépassé : plus proche de deux mois que de deux semaines.
Néanmoins, que cela soit chez les vétérinaires, chez les grossistes ou dans les laboratoires, les stocks coûtent toujours trop chers, si l'on en croit les gestionnaires.
La loi santé du 26 janvier 2016 renforce des dispositions déjà en vigueur depuis 2012 pour tenter de pallier les ruptures de médicaments humains majeurs. Depuis le 23 juillet dernier, un décret d'application oblige les laboratoires pharmaceutiques humains à prévoir des plans de gestion des pénuries. Car les industriels sont considérés comme les premiers responsables des ruptures. Ils sont donc en première ligne pour tenter de les éviter, au moins pour les vaccins et les médicaments dits d'intérêt thérapeutique majeur. Ces derniers sont définis comme ceux pour lesquels une interruption du traitement en cours est problématique pour la santé du patient.
Les industriels informent immédiatement l'Agence du médicament humain (ANSM) de toute rupture ou risque de rupture s'ils peuvent l'anticiper.
Ils doivent mettre en place des centres d'appels d'urgence permanents permettant à un pharmacien de leur signaler une rupture. Ils peuvent alors permettre un approvisionnement de cette pharmacie à partir des stocks d'urgence contingentés détenus par le laboratoire.
Enfin, depuis le nouveau décret du 20 juillet 2016, les laboratoires sont dans l'obligation de préparer, sous leur responsabilité, des plans de gestion des pénuries pour les médicaments les plus sensibles aux ruptures du fait, soit de l'absence d'alternative, soit de difficultés ou de fragilités dans la fabrication. Ces plans, déposés à l'ANSM, peuvent par exemple prévoir :
Les laboratoires pharmaceutiques vétérinaires ont aussi déjà l'obligation « d'informer l'Agence du médicament vétérinaire (ANMV) de tout risque de rupture de stock sur un médicament vétérinaire sans alternative thérapeutique disponible ou en raison d'un accroissement significatif et imprévisible de la demande » (article L. 5142-3-1).
Lorsqu'elle est informée, l'Agence peut accepter des mesures exceptionnelles si elles sont sollicitées par des industriels. Trois exemples.
2 mai 2024
 4 min
4 min

30 avril 2024
 5 min
5 min

29 avril 2024
 6 min
6 min

26 avril 2024
 5 min
5 min
25 avril 2024
 4 min
4 min

24 avril 2024
 4 min
4 min
