19 avril 2024
 4 min
4 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


19 juin 2019
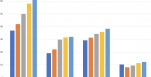
Prélevé sur tube sec ou EDTA, le LCR n'est pas modifié pour les analyses standard chez le chien
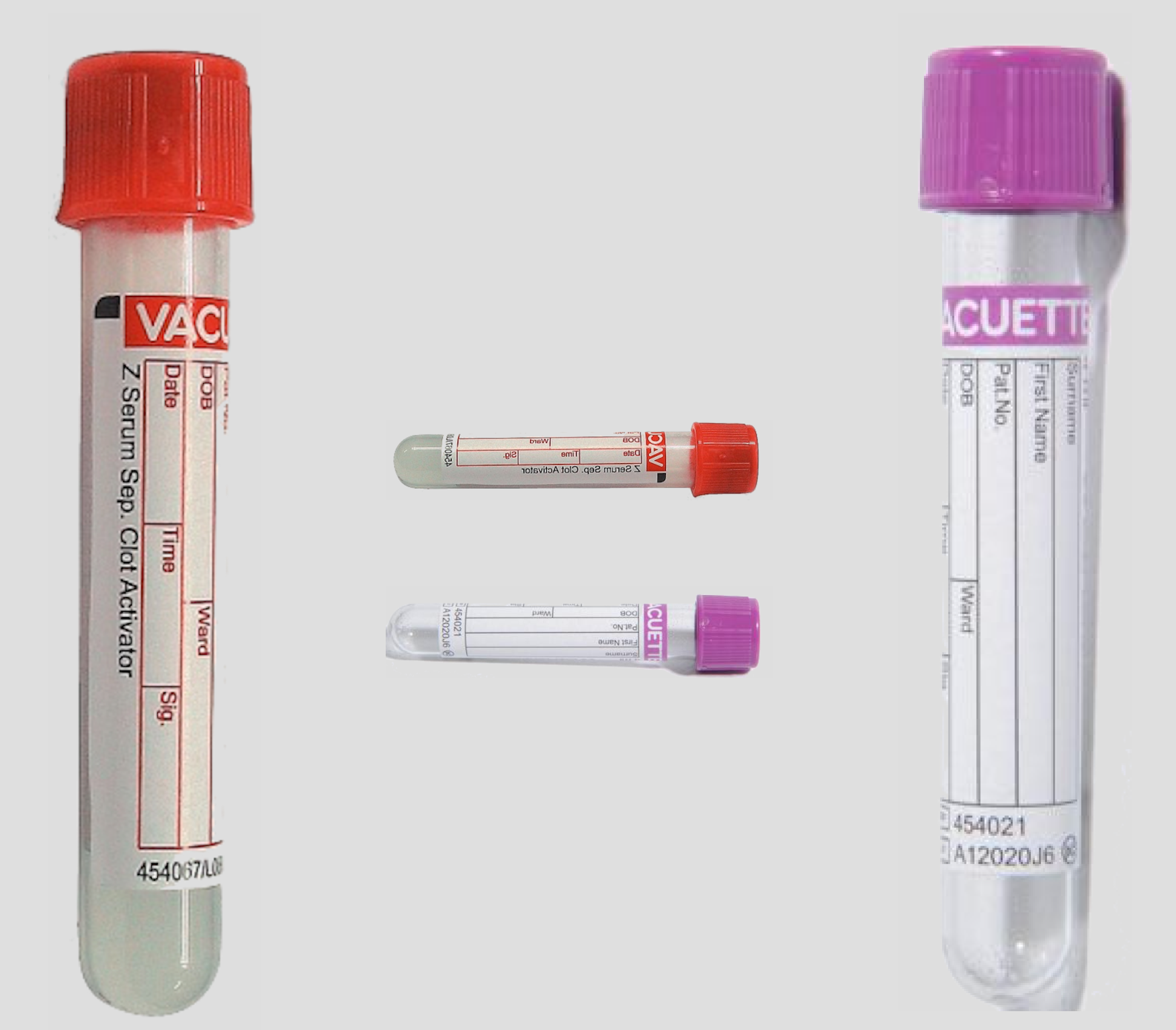
Qu'importe le tube pourvu qu'on ait le LCR… Que le bouchon soit rouge (tube sec) ou violet (tube avec EDTA), les deux types de tubes conviennent pour les analyses standard. Telle est la conclusion d'une validation conduite par des cliniciens et biologistes de l'hôpital vétérinaire de l'université de Copenhague (Danemark).
« Les tubes secs sont traditionnellement recommandés pour le prélèvement de LCR chez le chien. Cependant, il n'y a pas d'études validées à l'appui de cette pratique » notent les auteurs, qui soulignent qu'avec un tube EDTA, il est possible de « prévenir de l'effet d'une contamination du prélèvement par du sang, qui provoquerait une agglutination cellulaire » et risquerait de biaiser la lecture de résultats de cytologie. Mais, ajoutent-ils, il est suspecté que ces tubes puissent aussi provoquer une dilution du prélèvement, faussant la mesure des protéines totales. Ils ont donc réalisé une étude de validation comparant les résultats d'analyses standard du LCR avec des prélèvements réalisés avec les deux types de tubes. Pour ces auteurs, le terme d'analyses standard recouvre : « la numération du total des cellules nucléées, la mesure de la concentration en protéines, une évaluation cytologique et une numération cellulaire différentielle ».
Leur hypothèse est qu'il n'y a pas d'influence du tube pour la mesure de la concentration en protéines totales ni pour la numération, mais que l'EDTA « préserve mieux la morphologie des cellules ». Pour la vérifier, ils ont réalisé une ponction de LCR sur tous les chiens admis à l'hôpital vétérinaire entre février et juillet 2016 et pour lesquels une euthanasie devait être réalisée. Sur les 32 chiens inclus, 14 étaient euthanasiés en raison d'une maladie neurologie les 18 autres pour une autre cause. Le prélèvement a été réalisé par ponction aseptique haute, immédiatement après le décès du patient sous anesthésie générale. Dans tous les cas, le LCR a d'abord été recueilli sur un tube EDTA avant de l'être sur un tube sec. Selon le gabarit de l'animal, le prélèvement variait de 0,5 à 1 ml par tube ; il était analysé dans les 30 minutes suivant la ponction.
La concentration en protéines était mesurée sur bandelette (10 µl de LCR), lue (de 0 à 4+) par un même technicien, qui connaissait la nature du tube mais ignorait l'objectif de l'étude. Il n'a pas été identifié de différence significative pour ce critère semi-quantitatif (p>0,99).
Puis les tubes étaient agités avant la lecture par un technicien après avoir placé 10 µl de LCR dans les cellules de l'hémocytomètre, pour numération cellulaire totale. Là non plus, les auteurs n'observent pas de différence statistiquement différente (p=0,85) entre les mesures réalisées pour les deux types de tubes. Il n'y avait pas non plus de différence pour le dénombrement des érythrocytes (p=0,18). Pour le comptage cellulaire différentié, 200 µl de LCR ont été centrifugés, puis colorés pour lecture sur 200 cellules au total. Là non plus, il n'y avait pas de différence, ni sur les proportions des différents types cellulaires : cellules polynucléées (p=0,9), lymphocytes (p=0,84) et monocytes/macrophages (p=0,86). Au total, 68,8 % des LCR analysés ici étaient considérés comme « normaux ».
Le technicien, en aveugle au regard de la nature du tube de prélèvement, devait se prononcer sur le niveau de qualité de la morphologie des cellules, avec deux possibilités : satisfaisant (<25 % des cellules détruites ou non identifiables) ou non satisfaisant. Et les auteurs ne valident pas leur hypothèse :
La différence entre ces deux résultats n'est pas significative (p=0,45) et l'hypothèse des auteurs concernant la meilleure stabilité de la morphologie cellulaire grâce à l'EDTA est donc rejetée, ce que les auteurs trouvent « surprenant ». Ils l'attribuent au court délai entre le prélèvement et l'analyse, ayant préservé la qualité des prélèvements sur tube sec. Ainsi, la présence de l'EDTA n'influe pas sur le résultat des analyses standard, mais alors pourquoi changer les habitudes des neurologues ? Pour les cas où le délai entre prélèvement et l'analyse est plus long, avancent les auteurs, qui tiennent à leur hypothèse malgré tout… Puisqu'ils n'ont pas prélevé assez de LCR pour réaliser des lectures séquentielles.
19 avril 2024
 4 min
4 min

18 avril 2024
 3 min
3 min

17 avril 2024
 4 min
4 min

16 avril 2024
 7 min
7 min

15 avril 2024
 5 min
5 min
12 avril 2024
 4 min
4 min