24 avril 2024
 4 min
4 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


12 juin 2019
A 6 mois post-implantation intrapéritonéale de cellules pancréatiques, les chiens diabétiques vont bien
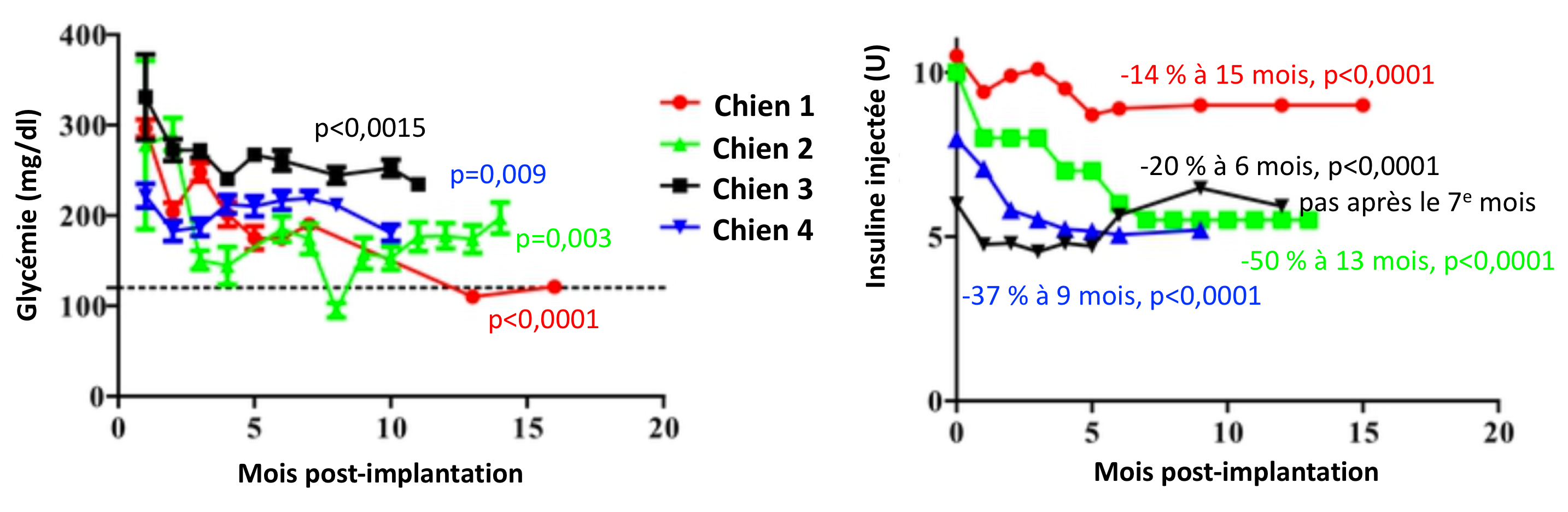

Moins d'un an après la présentation de résultats prometteurs en modèle souris pour la transplantation sous-cutanée de cellules d'îlots pancréatiques, d'autres chercheurs et cliniciens américains présentent de premiers résultats chez le chien selon le même principe, mais avec une implantation intrapéritonéale. Obtenus sur des chiens de compagnie (et non d'expérimentation), ces résultats sont favorables, entre 6 et 15 mois post-implantation.
Le dispositif testé dans l'essai est baptisé Neo-Islet°. Il est constitué d'agrégats de deux types de cellules cultivés in vitro : une « grande quantité » de cellules issues de cellules souches de tissu adipeux, qui se révèlent « cyto- et immunoprotectrices » et des cellules d'îlots ß du pancréas. Ces cellules d'origine adipeuse ont la capacité (vérifiée in vitro) de se différencier en lignées adipogène, ostéogène et chondrogène. Chaque agrégat (microscopique) contient donc les deux types cellulaires. Ils sont préparés en grande quantité (2 107 agrégats/ml) et transportés sous régime du froid jusqu'au site de transplantation, sous 48 h (l'ensemble des contrôles de la qualité et de la pureté du produit est présenté dans le manuscrit). Par rapport à d'autres pistes en cours d'exploration chez le chien, il n'y a pas ici de matrice englobant ce “greffon” cellulaire. En revanche, les cellules sont bien d'origine canine (transplantation allogénique).
Un essai a été autorisé par la FDA pour ce dispositif sur des chiens de compagnie diabétiques, avec trois objectifs : en évaluer l'innocuité, la faisabilité et l'efficacité à réduire ou éliminer le recours à l'insuline exogène dans la prise en charge du diabète. Six chiens ont été inclus dans l'essai, mais seuls quatre d'entre eux disposent d'un suivi de plus de 6 mois après l'implantation. Parmi les critères d'inclusion figuraient le poids (de 5 à 12 kg) un diabète insulino-dépendant équilibré, pas de processus cancéreux ni de contre-indication à une anesthésie générale. Les chiens inclus avaient un diabète identifié depuis 6 à 30 mois. Chaque chien a reçu la préparation contenant 2 105 nouveaux îlots par kg de poids vif, par voir intrapéritonéale (sédation et anesthésie locale, implantation échoguidée). Le chien rentrait chez lui le jour-même ; son propriétaire continuait à surveiller la glycémie (mesure biquotidienne et administration d'insuline exogène), et notait l'ensemble (ainsi que le poids et l'ingéré de manière hebdomadaire le premier mois, puis aux deux semaines). Des visites de contrôle sont effectuées tous les mois sur le premier semestre (examens complémentaires), puis tous les trimestres sur les 2,5 ans suivants (l'essai est prévu sur trois ans et pour 10 chiens).
Les quatre chiens auxquels se rapportent la publications ont tous plus de 6 mois de suivis, mais avec des durées renseignées différentes : de 10 à 17 mois. Aucun n'a présenté de trouble de la santé attribuable à l'intervention ni au greffon. Pour trois d'entre eux, il y a bien eu une réduction significative de l'apport exogène d'insuline à 6 mois post-implantation (voir l'illustration principale), toutefois :
Pour les trois autres chiens, la prise de sang avant l'implantation révélait la présence d'anticorps (IgG) dirigés contre les îlots ß du pancréas, faisant suspecter une origine auto-immune du diabète. Toutefois, chez ces trois chiens comme chez le 4e, il n'y a pas eu d'élévation de la concentration sérique en ces anticorps à 1,5 et 3 mois post-implantation, ni d'anticorps de rejet allogénique (les donneurs n'étaient pas apparentés aux receveurs, qui ne recevaient pas de traitement immunosuppresseur). Le recours aux « Neo-Islets° apparaît sûr et bien toléré » par ces quatre cas, malgré la présence de comorbidités chez certains d'eux. Pour les auteurs, les objectifs d'innocuité et de praticabilité sont donc atteints (sous réserve du reste de la période de suivi). Leur dispositif « fournit une amélioration efficace et durable du contrôle de la glycémie » mais ne permet pas d'éliminer le recours à l'insuline exogène – les auteurs suggèrent qu'une seconde implantation pourrait être nécessaire. Il reste qu'aucun des quatre chiens « n'a connu d'épisode hypoglycémique depuis la transplantation ». Des tests de tolérance au glucose seront réalisés à la fin de l'essai.
Les donneurs étaient des chiens euthanasiés, et les auteurs précisent qu'à partir d'un animal, ils peuvent « préparer 50 doses thérapeutiques de Neo-Islets° ».
24 avril 2024
 4 min
4 min

23 avril 2024
 4 min
4 min

22 avril 2024
 4 min
4 min

19 avril 2024
 4 min
4 min
18 avril 2024
 3 min
3 min

17 avril 2024
 4 min
4 min
